Tính chất hoá học của kim loại, dãy điện hoá kim loại – hoá 12 bài 18
- Hoá 12 bài 21: Cách điều chế kim loại và bài tập về điều chế kim loại
- Oppo vượt qua mọi đối thủ để dần chiếm lĩnh thị trường Trung Quốc và Việt Nam
- Giải SBT ngữ văn 7 cánh diều bài 2: Thơ bốn chữ, thơ năm chữ | SBT Ngữ Văn 7 tập 1 cánh diều
- Vật nào sau đây dao động với tần số lớn nhất?
- Cho Mình Hỏi “Christian” Và ” Catholic Là Gì ? Đạo Thiên Chúa Hay Đạo Công Giáo
Kim loại chiếm số lượng hơn 80% các nguyên tốt hoá học, kim loại được ứng dụng nhiều vào trong đời sống nhờ tính dẻo, dẫn điện và dẫn nhiệt.
Bạn đang xem: Tính chất hoá học của kim loại, dãy điện hoá kim loại – hoá 12 bài 18
Vậy Kim loại còn có tính chất hoá học, tính chất vật lý nào, cấu tạo của nguyên tử kim loại ra sao, dãy điện hoá kim loại có ý nghĩa gì? chúng ta hãy cùng tìm hiểu chi tiết qua bài viết dưới đây.
I. Tính chất vật lý của kim loại
Bạn đang xem: Tính chất hoá học của kim loại, dãy điện hoá kim loại – hoá 12 bài 18
– Ở điều kiện thường, các kim loại đều ở trạng thái rắn (trừ Hg), có tính dẻo, dẫn điện, dẫn nhiệt và có ánh kim.
1. Kim loại có tính dẻo
– Tính dẻo: dễ rèn, dễ dát mỏng và dễ kéo sợi.
– Kim loại có tính dẻo là vì các ion dương trong mạng tinh thể kim loại có thể trượt lên nhau dễ dàng mà không tách ra khỏi nhau nhờ những electron tự do chuyển động dính kết chúng với nhau.
 2. Kim loại có tính dẫn điện
2. Kim loại có tính dẫn điện
– Khi đặt một hiệu điện thế vào hai đầu dây kim loại, những electron chuyển động tự do trong kim loại sẽ chuyển động thành dòng có hướng từ cực âm đến cực dương, tạo thành dòng điện.
– Kim loại dẫn điện tốt nhất là Ag, sau đó đến Cu, Au, Al, Fe,…
– Ở nhiệt độ càng cao thì tính dẫn điện của kim loại càng giảm do ở nhiệt độ cao, các ion dương dao động mạnh cản trở dòng electron chuyển động.
3. Kim loại có tính dẫn nhiệt
– Các electron trong vùng nhiệt độ cao có động năng lớn, chuyển động hỗn loạn và nhanh chóng sang vùng có nhiệt độ thấp hơn, truyền năng lượng cho các ion dương ở vùng này nên nhiệt lan truyền được từ vùng này đến vùng khác trong khối kim loại.
– Thường các kim loại dẫn điện tốt cũng dẫn nhiệt tốt.
4. Kim loại có ánh kim
– Các electron tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng nhìn thấy được, do đó kim loại có vẻ sáng lấp lánh gọi là ánh kim.
– Tóm lại: Tính chất vật lí chung của kim loại gây nên bởi sự có mặt của các electron tự do trong mạng tinh thể kim loại.
– Không chỉ các electron tự do trong tinh thể kim loại, mà đặc điểm cấu trúc mạng tinh thể kim loại, bán kính nguyên tử,… cũng ảnh hưởng đến tính chất vật lí của kim loại.
– Ngoài những tính chất vật lí chung của kim loại như đã nói ở trên, kim loại còn có một số tính chất vật lí không giống nhau. Những kim loại khác nhau có khối lượng riêng, nhiệt độ nóng chảy và tính cứng khác nhau.
II. Tính chất hoá học của Kim loại
– Tính chất hóa học của các kim loại là tính khử:
M → Mn+ + ne
1. Tác dụng với phi kim
– Nhiều kim loại có thể khử được phi kim đến số oxi hoá âm, đồng thời nguyên tử kim loại bị oxi hoá đến số oxi hoá dương.
a) Tác dụng với Oxi
– Hầu hết các kim loại đều tham gia phản ứng trừ Au, Pt, và Ag → oxit bazơ hoặc oxit lưỡng tính.
2xM + yO2 → 2MxOy
* Ví dụ: ![small 4overset{0}{Al}+2overset{0}{O_{2}}xrightarrow[]{t^{0}}2overset{+3}{Al_{2}}overset{-2}{O_{3}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/15483879807gegcwhha6.gif)
– Mức độ phản ứng với oxi của các kim loại khác nhau: kim loại càng mạnh thì phản ứng càng mạnh.
+ K, Na cháy tạo thành oxit khi có lượng oxi hạn chế. Nếu oxi dư thì tạo thành peoxit.
+ Ca, Mg, Al, Zn, Fe cháy tạo thành oxit và khả năng phản ứng với oxi giảm dần.
+ Các kim loại từ Pb → Hg không cháy nhưng tạo thành màng oxit trên bề mặt.
+ Các kim loại từ Ag → Au không cháy và không tạo thành lớp màng oxit trên bề mặt.
– Phản ứng với oxi của kim loại phụ thuộc vào bề mặt của lớp oxit tạo thành: nếu bề mặt không khít thì phản ứng hoàn toàn; nếu bề mặt khít thì chỉ phản ứng ở trên bề mặt như Al, Zn…
b) Tác dụng với Clo
– Các kim loại đều tác dụng với clo khi đun nóng → muối clorua (Kim loại có hóa trị cao).
2M + nCl2 → 2MCln
* Ví dụ: ![small 2overset{0}{Fe}+3overset{0}{Cl_{2}}xrightarrow[]{t^{0}}2overset{+3}{Fe}overset{-1}{Cl_{3}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/1548387982k0b8lrjokl.gif)
c) Tác dụng với lưu huỳnh
– Hầu hết kim loại có thể khử lưu huỳnh từ số oxi hoá 0 (S0) xuống oxi hoá -2 (S-2). Phản ứng cần đun nóng trừ Hg.
![small overset{0}{Fe}+overset{0}{S}xrightarrow[]{t^{0}}FeS](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/1548387984usvhtxqe92.gif)
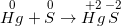
– Các kim loại còn phản ứng được với nhiều phi kim khác như Br2, I2, …
2. Kim loại tác dụng với dung dịch axit
a) Với các dung dịch axit HCl, H2SO4 loãng
– Chỉ kim loại đứng trước H2 trong dãy điện hoá mới có phản ứng → muối (trong đó kim loại chỉ đạt đến hóa trị thấp) + H2↑.
Fe + H2SO4 loãng → FeSO4 + H2↑
Xem thêm : Thuốc Corticoid là gì? Có tác dụng gì? Chống chỉ định khi nào?
Mg + HCl loãng → MgCl2 + H2↑
Chú ý: Na, K, Ba, Ca… khi cho vào ddịch axit thì phản ứng với H+ trước, nếu dư thì phản ứng với H2O. Pb đứng trước nhưng không tác dụng với HCl và H2SO4 loãng do tạo muối khó tan bám trên mặt cản trở phản ứng.
b) Với các dung dịch axit HNO3, H2SO4 đặc, nóng
– Hầu hết các kim loại đều có phản ứng (trừ Au, Pt) muối (KL có hóa trị cao nhất) + H2O + sản phẩm được hình thành từ sự khử S+6 hoặc N+5.
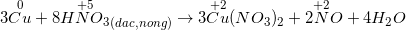
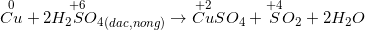
*Lưu ý: Al, Fe, Cr thụ động với H2SO4 đặc nguội và HNO3 đặc nguội.
3. Kim loại tác dụng với nước
a) Ở nhiệt độ thường
– Chỉ có kim loại kiềm và kiềm thổ (nhóm IA và IIA) như Na, K, Ba và Ca phản ứng → kiềm + H2.
– Phản ứng tổng quát:
2M + 2nH2O → 2M(OH)n + nH2
b) Phản ứng ở nhiệt độ cao
– Mg và Al có phản ứng phức tạp:
Mg + 2H2O ![small xrightarrow[]{100^{0}C}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/giflatexsmallspacexrightarrow100_1548387991.gif) Mg(OH)2 + H2 (1000C)
Mg(OH)2 + H2 (1000C)
Mg + H2O ![small small xrightarrow[]{geqslant 200^{0}C}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/1548387993qh8qfru4gl.gif) MgO + H2
MgO + H2
– Mn, Zn, Cr, Fe ở nhiệt độ cao phản ứng với hơi nước → oxit kim loại + H2.
3Fe + 4H2O ![small xrightarrow[]{<570^{0}C}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/giflatexsmallspacexrightarrow570_1548387994.gif) Fe3O4 + 4H2↑
Fe3O4 + 4H2↑
Fe + H2O ![small xrightarrow[]{>570^{0}C}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/giflatexsmallspacexrightarrow570_1548387996.gif) FeO + H2↑
FeO + H2↑
– Ag và Au không khử được H2O.
4. Kim loại tác dụng với dung dịch muối
– Với Na, K, Ca và Ba phản ứng với nước trước sau đó dung dịch kiềm tạo thành sẽ phản ứng với muối.
– Với các kim loại không tan trong nước, kim loại hoạt động (đứng trước) đẩy được kim loại kém hoạt động (đứng sau) ra khỏi dung dịch muối của chúng theo quy tắc α.
Fe + CuSO4 → FeSO4 + Cu↓
* Chú ý:
2Fe3+ + Fe → 3Fe2+
Cu + 2Fe3+ → Cu2+ + 2Fe2+
Fe2+ + Ag+ → Ag + Fe3+
5. Kim loại tác dụng với dung dịch kiềm
– Các kim loại tan trong nước: Na, K, Ca và Ba tác dụng với nước có trong dung dịch.
– Một số kim loại có hiđroxit tương ứng là chất lưỡng tính + dung dịch bazơ → muối + H2.
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑
III. Dãy điện hoá của Kim loại
1. Cặp oxi hóa – khử của kim loại
Nguyên tử kim loại dễ nhường electron để trở thành ion kim loại, ngược lại ion kim loại có thể nhận electron để trở thành nguyên tử kim loại.
Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử của kim loại.
2. So sánh tính chất của các cặp oxi hóa – khử
Thí dụ: So sánh tính chất của hai cặp oxi hóa – khử Cu2+/Cu và Ag+/Ag.
– Thực nghiệm cho thấy Cu tác dụng được với dung dịch muối AgNO3 theo phương trình ion rút gọn:
Cu + 2Ag+ → Cu2++2Ag
– Trong khi đó, ion Cu2+ không oxi hóa được Ag. Như vậy, ion Cu2+ có tính oxi hóa yếu hơn ion Ag+ và kim loại Cu có tính khử mạnh hơn kim loại Ag.
3. Dãy điện hóa của kim loại
– Người ta đã so sánh tính chất của nhiều cặp oxi hóa – khử và sắp xếp thành dãy điện hóa của kim loại:

4. Ý nghĩa của dãy điện hóa của kim loại
– Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa 2 cặp oxi hóa – khử theo quy tắc α: Phản ứng giữa 2 cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
IV. Bài tập về tính chất hoá học của kim loại
Bài 3 trang 88 sgk hoá 12: Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thủy ngân bị vỡ thì có thể dùng chất nào trong các chất sau để khử độc thủy ngân?
A. Bột sắt. B. Bột lưu huỳnh.
C. Natri. D. Nước.
Xem thêm : Comeback là gì? Điểm khác biệt giữa comeback và come back
Lời giải bài 3 trang 88 sgk hoá 12:
* Đáp án: B. bột lưu huỳnh
Vì Hg độc nhưng khi: Hg + S → HgS (không độc)
Bài 4 trang 89 sgk hoá 12: Dung dịch FeSO4 có lẫn tạp chất là CuSO4. Hãy giới thiệu phương pháp hóa học đơn giản để có thể loại được tạp chất. Giải thích việc làm viết phương trình phản ứng dạng phân tử và ion thu gọn.
Lời giải bài 4 trang 89 sgk hoá 12:
– Cho một thanh sắt sạch vào dung dịch có phản ứng
Fe + CuSO4 → FeSO4 + Cu
– Toàn bộ Cu thoát ra bám trên bề mặt thanh sắt, lấy thanh sắt ra ta còn lại dung dịch chỉ có FeSO4
Fe + CuSO4 → FeSO4 + Cu
Fe + Cu2+→ Fe2++ Cu
Bài 5 trang 89 sgk hoá 12: Nhúng một lá sắt nhỏ vào dung dịch chứa một trong những chất sau: FeCl3, AlCl3, CuSO4, Pb(NO3)2, NaCl, HCl, HNO3, H2SO4(đặc nóng), NH4NO3. Số trường hợp phản ứng tạo muối Fe(II) là
A.3. B.4. C.5. D.6.
Lời giải bài 5 trang 89 sgk hoá 12:
* Đáp án: B.4
– Các chất là FeCl3, CuSO4, Pb(NO3)2, HCl
Fe + 2FeCl3 → 3FeCl2
Fe + CuSO4 → FeSO4 + Cu
Fe + Pb(NO3)2 → Fe(NO3)2 + Pb
Fe + 2HCl → FeCl2 + H2
Bài 6 trang 89 sgk hóa 12: Cho 5,5 gam hỗn hợp Al và Fe (trong đó số mol Al gấp đôi số mol Fe) vào 300 ml dung dịch AgNO3 1M. Khuấy kỹ đến phản ứng hoàn toàn thu m gam chất rắn. Giá trị của m là :
A. 33,95 g B. 35,2g
C. 39,35g D. 35,39g
Lời giải bài 6 trang 89 sgk hóa 12:
* Đáp án: B.35,2 (g)
Các phương trình hóa học có thể xảy ra :
Al + 3Ag+ → Al3+ + 3Ag (1)
x 3x 3x
Fe + 3Ag+ → Fe3+ + 3Ag (2)
0,5x 1,5x 1,5x
– Theo bài ra ta có:nAgNO3 = 0,3. 1 = 0,3 mol
– Ta gọi số mol Al là x thì số mol Fe là 0,5x
Theo đề bài ta có: 27x + 56. 0,5x = 5,5 ⇒ x = 0,1 mol
Theo PTPƯ (1) thì: nAgNO3 = 3.nAl = 3.0,1 = 0,3 (mol) do đó chỉ xảy ra phản ứng (1).
– Chất rắn thu được sau phản ứng là Ag và Fe
– Khối lượng chất rắn = mAg + mFe = 0,3.108 + 0,1.0,5.56 = 35,2 (g)
Bài 7 trang 89 sgk hóa 12: Hãy sắp xếp theo chiều giảm tính khử và chiều tăng tính oxi hoá của các nguyên tử và ion trong hai trường hợp sau đây:
a) Fe, Fe2+, Fe3+, Zn, Zn2+, Ni, Ni2+, H, H+, Hg, Hg2+, Ag, Ag+.
b) Cl, Cl–, Br, Br–, F, F–, I, I–.
Lời giải bài 7 trang 89 sgk hóa 12:
a) Giảm tính khử: Zn > Fe > Ni > H > Hg > Ag
Tăng tính oxi hóa: Zn2+ < Fe2+ < Ni2+ < H+ < Hg2+ < Fe3+ < Ag+
b) Giảm tính khử: I– > Br– > Cl– > F–
Tăng tính oxi hóa: I < Br < Cl < F.
Hi vọng với phần ôn tập hệ thống lại kiến thức về tính chất hoá học của kim loại và dãy điện hoá của kim loại ở trên hữu ích cho các em. Mọi thắc mắc các em hãy để lại lời nhắn dưới phần bình luận để góp ý và nhận hỗ trợ, nếu thấy hay hãy chia sẻ bài viết, chúc các em học tập tốt.
¤ Xem thêm các bài viết khác tại:
Đăng bởi: thcs Hồng Thái
Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường THCS Hồng Thái Hải Phòng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường thcs Hồng Thái (thcshongthaiad.edu.vn)
Nguồn: https://thcshongthaiad.edu.vn
Danh mục: Tra Cứu
