Hoá 8 bài 21: Cách tính theo công thức hoá học và bài tập vận dụng
- 99+ Hình ảnh gái xinh, Hot girl việt nam đẹp nhất 2021
- Hãy cho biết điểm khác nhau giữa lấp, nén đất lần 1 và lần 2. | SBT công nghệ 7 chân trời
- Apple Unveils March 21 Event: Speculations on the New iPhone
- Công thức tính nguyên hàm và bảng nguyên hàm Đầy Đủ, Chính Xác
- Mẫu báo cáo kết quả tập sự 2021 (3 mẫu) Cách viết báo cáo cho viên chức hết thời gian tập sự
Hoá 8 bài 21: Cách tính theo công thức hoá học và bài tập vận dụng. Nếu biết công thức hoá học của 1 chất các em có thể xác định được tỉ lệ phần trăm của các nguyên tố đó. ngược lại nếu biết được thành phần phần trăm của các nguyên tố trong hợp chất, các em cũng có thể xác định được công thức hoá học của nó
Bạn đang xem: Hoá 8 bài 21: Cách tính theo công thức hoá học và bài tập vận dụng
Bài viết dưới đây sẽ hệ thống kiến thức cần nhớ về cách tính theo công thức hoá học để các em có thể nắm vững các dạng bài tập hoá học 8 liên quan đến chủ đề này.
I. Tính thành phần % về khối lượng của nguyên tố trong hợp chất
– Từ công thức hoá học (CTHH) đã cho AxBy ta dễ dàng tính được %A,%B theo công thức sau:
%![]() .100%
.100%
%![]() .100%
.100%
– Trong đó: MA, MB và MAxBy lần lượt là khối lượng mol của A, B và AxBy.
* Lưu ý: Công thức trên có thể mở rộng cho các hợp chất có 3, 4,.. nguyên tố.
* Ví dụ 1: Tính thành phần % về khối lượng của nguyên tố sắt có trong sắt (III) oxit Fe2O3
Hướng dẫn: Ta có: Fe = 56 ⇒ MFe = 56 (g).
Fe2O3 = 2.56 + 3.16 = 160 ⇒ MFe2O3 = 160g.
Bạn đang xem: Hoá 8 bài 21: Cách tính theo công thức hoá học và bài tập vận dụng
%mFe = 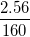 .100%= 70%
.100%= 70%
⇒ Từ trên có thể tính % khối lượng của Oxi có trong Fe2O3 là: 100% – 70% = 30%
* Ví dụ 2: Tính thành phần % về khối lượng của các nguyên tố có trong vôi tôi Ca(OH)2
Hướng dẫn: Ta có Ca = 40, O = 16, H = 1; trong 1 mol Ca(OH)2 có 1 nguyên tử Ca, 2 nguyên tử O, 2 nguyên tử H. MCa(OH)2 = 40 + 2.16 + 2.1 = 74
Thành phần % của các nguyên tử có trong hợp chất là:
%mCa = 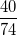 .100% = 54,05%
.100% = 54,05%
%mO = 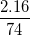 .100% = 43,25%
.100% = 43,25%
%mH = 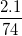 .100% = 2,70
.100% = 2,70
hoặc %mH = 100% – %mCa – %mO = 100% – 54,05% – 43,25% = 2,7%
II. Tính tỉ số khối lượng của các nguyên tố trong hợp chất
– Từ công thức hoá học đã cho AxBy ta có thể lập được tỉ số khối lượng của các nguyên tố:
mA : mB = x.MA : y.MB
* Ví dụ 1: Xác định tỉ số khối lượng của các nguyên tố cacbon và hidro trong khí metan CH4
Hướng dẫn: Ta có: C = 12, H = 1;
trong 1 mol CH4 có 1 nguyên tử C, 4 nguyên tử H
mC : mH = 1.12 : 4.1 = 12 : 4 = 3 : 1
Lưu ý: Nếu đã biết thành phần % về khối lượng của các nguyên tố thì lập tỉ số theo tỉ lệ thành phần % này, ví dụ, theo như Fe2O3 ở trên ta đã tính được %mFe = 70% và %mO = 30% khi đó mFe : mO = 7:3.
* Ví dụ 2: Xác định tỉ số khối lượng của các nguyên tố lưu huỳnh và oxi trong đồng sunfat CuSO4
Hướng dẫn: Ta có Cu = 64, S = 32, O = 16; trong 1 mol CuSO4 có 1 nguyên tử Cu, 1 nguyên tử S và 4 nguyên tử O
mS : mO = 1.32 : 4.16 = 32 : 64 = 1 : 2
III. Tính khối lượng của nguyên tố có trong một lượng chất đã biết
– Nếu có m là khối lượng của một hợp chất đã biết CTHH là AxBy ta có thể tính mA là khối lượng của nguyên tố A theo công thức sau:
![]()
* Ví dụ 1: Tính khối lượng của nguyên tố oxi có trong 8 (g) muối đồng sunfat CuSO4
Hướng dẫn: Ta có: CuSO4 = 64 + 32 + 64 = 160 ⇒ MCuSO4 = 160g
![]()
Xem thêm : 99+ Hình nền Nezuko cute, Ảnh nền Nezuko dễ thương
* Ví dụ 2: Tính khối lượng của nguyên tố N có trong 0,2 mol muối kali nitrat KNO3
Hướng dẫn: Ta có: KNO3 = 39 + 14 + 3.16 = 101 ⇒ MKNO3 = 101g ⇒ mKNO3 = 101.0,2 = 20,2 g
![]()
Lưu ý: Khi biết thành phần % về khối lượng của nguyên tố thì ta tính theo giá trị % này, nhân nó với khối lượng cho biết của chất, ví dụ, tính khối lượng sắt có trong 5kg sắt (III) oxit, biết thành phần % về khối lượng của sắt là 70% : mFe = 0,7.5 = 3,5 (kg)
IV. Cách xác định công thức hoá học của hợp chất
1. Khi biết thành phần % về khối lượng của các nguyên tố và phân tử khối
– Cho biết %A, %B ta cần tìm các chỉ số x, y
* Ví dụ: Xác định CTHH của một oxit biết phân tử khối của oxit bằng 160 và thành phần % về khối lượng của nguyên tố sắt là 70%
Hướng dẫn: Ta gọi CTHH của oxit cần tìm là FexOy
– Để tính các chỉ số x, y ta lập tỉ lệ khối lượng của các nguyên tố và hợp chất:
![]() và
và ![]()
Suy ra: ![]()
⇒ CTHH của oxit là : Fe2O3
* Lưu ý: Khi không biết phân tử khối của chất, giả sử không biết số trị 160 trong ví dụ trên, ta tìm tỉ lệ giữa các chỉ số x, y (số nguyên). Muốn vậy, ta viết x thay vào chỗ số trị 160 trong các phép tính trên, rồi lấy x chia cho y ta được:
Vậy công thức là Fe2O3
2. Khi biết tỉ số khối lượng của các nguyên tố và phân tử khối
– Cho biết tỉ số mA : mB = a : b. Cần tìm các chỉ số x, y.
* Ví dụ: Xác định CTHH một oxit của nitơ, biết phân tử khối bằng 46 và tỉ số khối lượng mN : mO = 3,5 : 8
Hướng dẫn: Ta gọi công thức hóa học cần tìm có dạng NxOy
– Ta có: x . 14 + y . 16 = 46 (1)
– Lập tỉ số khối lượng: mN : mO = x . 14 : y . 16 = 3,5 : 8
Rút ra tỉ lệ: x : y = (3,5/14):(8/16) = 0,25 : 0,5 = 1:2
Suy ra: 2x = y, thay vào (1) và giải ta được: x = 1 và y = 2
⇒ Công thức hóa học của oxit là NO2
– Hoặc giải theo cách sau:
Từ tỉ lệ 1 : 2 có thể viết công thức ở dạng (NO2)n.
Phân tử khối của oxit là 46, tức n(14 + 2.16) = 46. Suy ra n = 1
Do đó x = n = 1 và y = 2n = 2. CTHH là NO2
3. Trong bài toán có thể cho dữ kiện để tìm phân tử khối
– Ta sẽ đi vào ví dụ cụ thể để các em hiểu rõ cách tính
Ví dụ: Biết axit HxSyOz có %S = 32,65% và y = 1. Tính phân tử khối của axit.
* Hướng dẫn:
Ta có %S = ![]() .100%
.100%
⇒ ![]()
Vậy phân tử khối của axit HxSyOz là 98
Ví dụ 2: Biết 1 lít khí axetilen (khí đất đèn) nặng 1,16g. Tính phân tử khối của khí axetilen
* Hướng dẫn: Ta có: V = n.22,4 ⇒ n=V/22,4
mặt khác, ta có: M = m/n
Theo bài ra ta có: m = 1,16g, V = 1 lít
Vậy suy ra khối lượng mol của khí axetilen bằng M = 1,16.22,4 = 26 (g).
V. Bài tập về cách tính theo công thức hóa học
Xem thêm : Đề đọc hiểu Những ngôi sao xa xôi
Bài 2 trang 71 sgk hóa 8: Hãy tìm công thức hóa học của những hợp chất có thành phần các nguyên tố như sau
a) Hợp chất A có khối lượng mol phân tử là 58,5g có thành phần các nguyên tố 60,68% Cl và còn lại là Na.
b) Hợp chất B có khối lượng mol phân tử là 106g, thành phần 43,4% Na 11,3% C và 45,3% O.
Lời giải bài 2 trang 71 sgk hóa 8:
a) Ta có: %Cl = 60,68%
⇒ mCl = ![]()
⇒ nCl = ![]()
⇒ mNa = 58,5 – 35,5 = 23
nNa = ![]()
Vậy trong 1 phân tử hợp chất A có : 1 nguyên tử Na và 1 nguyên tử Cl.
⇒ CTHH của A là: NaCl
b) Tương tự: Ta tính được mNa = 46 (g); mC = 12 (g); mO = 48 (g)
⇒ nNa = 2 (mol); nC = 1 (mol); nO = 3 (mol)
Vậy trong 1 phân tử hợp chất A có : 2 nguyên tử Na,1 nguyên tử C và 3 nguyên tử O.
⇒ CTHH của A là: Na2CO3
Bài 4 trang 71 sgk hóa 8: Một loại oxit đồng màu đen có khối lượng mol phân tử là 80g. Oxit này có thành phần là 80% Cu và 20% O. Hãy tìm công thức hóa học của loại oxit đồng nói trên.
Lời giải bài 4 trang 71 sgk hóa 8:
Ta có: mCu = 80.80/100 = 64g
⇒ nCu = 64/64 = 1 mol nguyên tử Cu.
Lại có: mO = 20.80/100 = 16.
⇒ nO = 16/16 = 1 mol nguyên tử O.
Vậy trong 1 phân tử hợp chất có 1 nguyên tử Cu và 1 nguyên tử O.
⇒ Công thức của oxit đồng màu đen là CuO.
Bài 5 trang 71 sgk hóa 8: Hãy tìm công thức hóa học của khí A.
– Khí A nặng hơn khí hiđro 17 lần.
– Thành phần theo khối lượng của khí A là 5,88% H và 94,12% S.
Lời giải bài 5 trang 71 sgk hóa 8:
– Khối lượng mol của khí A : dA/H2 = 17 ⇒ MA = 17.2 = 34 (g)
– Theo bài ra ta có khối lượng mỗi nguyên tố có trong 1 mol khí A:
⇒ mH =(34.5,88)/100 = 2 (g)
⇒ mS = 34 – 2 = 32 (g)
Số mol nguyên tử mỗi nguyên tố trong 1 mol khí A là: nH = 2/1 = 2(mol); nS = 32/32 = 1 (mol)
Vậy trong 1 mol phân tử chất A có : 2 nguyên tử H và 1 nguyên tử S
⇒ CTHH của khí A là H2S
Hy vọng với phần hệ thống lại cách tính theo công thức hóa học với các dạng toán ở trên hữu ích cho các em. Mọi thắc mắc các em hãy để lại bình luận dưới bài viết, và chia sẻ nếu thấy bài viết hay. Chúc các em học tốt!
Đăng bởi: thcs Hồng Thái
Chuyên mục: Giáo Dục
Xem thêm Hoá 8 bài 21
Hoá 8 bài 21: Cách tính theo công thức hoá học và bài tập vận dụng. Nếu biết công thức hoá học của 1 chất các em có thể xác định được tỉ lệ phần trăm của các nguyên tố đó. ngược lại nếu biết được thành phần phần trăm của các nguyên tố trong hợp chất, các em cũng có thể xác định được công thức hoá học của nó Bài viết dưới đây sẽ hệ thống kiến thức cần nhớ về cách tính theo công thức hoá học để các em có thể nắm vững các dạng bài tập hoá học 8 liên quan đến chủ đề này. I. Tính thành phần % về khối lượng của nguyên tố trong hợp chất – Từ công thức hoá học (CTHH) đã cho AxBy ta dễ dàng tính được %A,%B theo công thức sau: %.100% %.100% – Trong đó: MA, MB và MAxBy lần lượt là khối lượng mol của A, B và AxBy. * Lưu ý: Công thức trên có thể mở rộng cho các hợp chất có 3, 4,.. nguyên tố. * Ví dụ 1: Tính thành phần % về khối lượng của nguyên tố sắt có trong sắt (III) oxit Fe2O3 Hướng dẫn: Ta có: Fe = 56 ⇒ MFe = 56 (g). Fe2O3 = 2.56 + 3.16 = 160 ⇒ MFe2O3 = 160g. %mFe = .100%= 70% ⇒ Từ trên có thể tính % khối lượng của Oxi có trong Fe2O3 là: 100% – 70% = 30% * Ví dụ 2: Tính thành phần % về khối lượng của các nguyên tố có trong vôi tôi Ca(OH)2 Hướng dẫn: Ta có Ca = 40, O = 16, H = 1; trong 1 mol Ca(OH)2 có 1 nguyên tử Ca, 2 nguyên tử O, 2 nguyên tử H. MCa(OH)2 = 40 + 2.16 + 2.1 = 74 Thành phần % của các nguyên tử có trong hợp chất là: %mCa = .100% = 54,05% %mO = .100% = 43,25% %mH = .100% = 2,70 hoặc %mH = 100% – %mCa – %mO = 100% – 54,05% – 43,25% = 2,7% II. Tính tỉ số khối lượng của các nguyên tố trong hợp chất – Từ công thức hoá học đã cho AxBy ta có thể lập được tỉ số khối lượng của các nguyên tố: mA : mB = x.MA : y.MB * Ví dụ 1: Xác định tỉ số khối lượng của các nguyên tố cacbon và hidro trong khí metan CH4 Hướng dẫn: Ta có: C = 12, H = 1; trong 1 mol CH4 có 1 nguyên tử C, 4 nguyên tử H mC : mH = 1.12 : 4.1 = 12 : 4 = 3 : 1 Lưu ý: Nếu đã biết thành phần % về khối lượng của các nguyên tố thì lập tỉ số theo tỉ lệ thành phần % này, ví dụ, theo như Fe2O3 ở trên ta đã tính được %mFe = 70% và %mO = 30% khi đó mFe : mO = 7:3. * Ví dụ 2: Xác định tỉ số khối lượng của các nguyên tố lưu huỳnh và oxi trong đồng sunfat CuSO4 Hướng dẫn: Ta có Cu = 64, S = 32, O = 16; trong 1 mol CuSO4 có 1 nguyên tử Cu, 1 nguyên tử S và 4 nguyên tử O mS : mO = 1.32 : 4.16 = 32 : 64 = 1 : 2 III. Tính khối lượng của nguyên tố có trong một lượng chất đã biết – Nếu có m là khối lượng của một hợp chất đã biết CTHH là AxBy ta có thể tính mA là khối lượng của nguyên tố A theo công thức sau: * Ví dụ 1: Tính khối lượng của nguyên tố oxi có trong 8 (g) muối đồng sunfat CuSO4 Hướng dẫn: Ta có: CuSO4 = 64 + 32 + 64 = 160 ⇒ MCuSO4 = 160g * Ví dụ 2: Tính khối lượng của nguyên tố N có trong 0,2 mol muối kali nitrat KNO3 Hướng dẫn: Ta có: KNO3 = 39 + 14 + 3.16 = 101 ⇒ MKNO3 = 101g ⇒ mKNO3 = 101.0,2 = 20,2 g Lưu ý: Khi biết thành phần % về khối lượng của nguyên tố thì ta tính theo giá trị % này, nhân nó với khối lượng cho biết của chất, ví dụ, tính khối lượng sắt có trong 5kg sắt (III) oxit, biết thành phần % về khối lượng của sắt là 70% : mFe = 0,7.5 = 3,5 (kg) IV. Cách xác định công thức hoá học của hợp chất 1. Khi biết thành phần % về khối lượng của các nguyên tố và phân tử khối – Cho biết %A, %B ta cần tìm các chỉ số x, y * Ví dụ: Xác định CTHH của một oxit biết phân tử khối của oxit bằng 160 và thành phần % về khối lượng của nguyên tố sắt là 70% Hướng dẫn: Ta gọi CTHH của oxit cần tìm là FexOy – Để tính các chỉ số x, y ta lập tỉ lệ khối lượng của các nguyên tố và hợp chất: và Suy ra: ⇒ CTHH của oxit là : Fe2O3 * Lưu ý: Khi không biết phân tử khối của chất, giả sử không biết số trị 160 trong ví dụ trên, ta tìm tỉ lệ giữa các chỉ số x, y (số nguyên). Muốn vậy, ta viết x thay vào chỗ số trị 160 trong các phép tính trên, rồi lấy x chia cho y ta được: Vậy công thức là Fe2O3 2. Khi biết tỉ số khối lượng của các nguyên tố và phân tử khối – Cho biết tỉ số mA : mB = a : b. Cần tìm các chỉ số x, y. * Ví dụ: Xác định CTHH một oxit của nitơ, biết phân tử khối bằng 46 và tỉ số khối lượng mN : mO = 3,5 : 8 Hướng dẫn: Ta gọi công thức hóa học cần tìm có dạng NxOy – Ta có: x . 14 + y . 16 = 46 (1) – Lập tỉ số khối lượng: mN : mO = x . 14 : y . 16 = 3,5 : 8 Rút ra tỉ lệ: x : y = (3,5/14):(8/16) = 0,25 : 0,5 = 1:2 Suy ra: 2x = y, thay vào (1) và giải ta được: x = 1 và y = 2 ⇒ Công thức hóa học của oxit là NO2 – Hoặc giải theo cách sau: Từ tỉ lệ 1 : 2 có thể viết công thức ở dạng (NO2)n. Phân tử khối của oxit là 46, tức n(14 + 2.16) = 46. Suy ra n = 1 Do đó x = n = 1 và y = 2n = 2. CTHH là NO2 3. Trong bài toán có thể cho dữ kiện để tìm phân tử khối – Ta sẽ đi vào ví dụ cụ thể để các em hiểu rõ cách tính Ví dụ: Biết axit HxSyOz có %S = 32,65% và y = 1. Tính phân tử khối của axit. * Hướng dẫn: Ta có %S = .100% ⇒ Vậy phân tử khối của axit HxSyOz là 98 Ví dụ 2: Biết 1 lít khí axetilen (khí đất đèn) nặng 1,16g. Tính phân tử khối của khí axetilen * Hướng dẫn: Ta có: V = n.22,4 ⇒ n=V/22,4 mặt khác, ta có: M = m/n Theo bài ra ta có: m = 1,16g, V = 1 lít Vậy suy ra khối lượng mol của khí axetilen bằng M = 1,16.22,4 = 26 (g). V. Bài tập về cách tính theo công thức hóa học Bài 2 trang 71 sgk hóa 8: Hãy tìm công thức hóa học của những hợp chất có thành phần các nguyên tố như sau a) Hợp chất A có khối lượng mol phân tử là 58,5g có thành phần các nguyên tố 60,68% Cl và còn lại là Na. b) Hợp chất B có khối lượng mol phân tử là 106g, thành phần 43,4% Na 11,3% C và 45,3% O. Lời giải bài 2 trang 71 sgk hóa 8: a) Ta có: %Cl = 60,68% ⇒ mCl = ⇒ nCl = ⇒ mNa = 58,5 – 35,5 = 23 nNa = Vậy trong 1 phân tử hợp chất A có : 1 nguyên tử Na và 1 nguyên tử Cl. ⇒ CTHH của A là: NaCl b) Tương tự: Ta tính được mNa = 46 (g); mC = 12 (g); mO = 48 (g) ⇒ nNa = 2 (mol); nC = 1 (mol); nO = 3 (mol) Vậy trong 1 phân tử hợp chất A có : 2 nguyên tử Na,1 nguyên tử C và 3 nguyên tử O. ⇒ CTHH của A là: Na2CO3 Bài 4 trang 71 sgk hóa 8: Một loại oxit đồng màu đen có khối lượng mol phân tử là 80g. Oxit này có thành phần là 80% Cu và 20% O. Hãy tìm công thức hóa học của loại oxit đồng nói trên. Lời giải bài 4 trang 71 sgk hóa 8: Ta có: mCu = 80.80/100 = 64g ⇒ nCu = 64/64 = 1 mol nguyên tử Cu. Lại có: mO = 20.80/100 = 16. ⇒ nO = 16/16 = 1 mol nguyên tử O. Vậy trong 1 phân tử hợp chất có 1 nguyên tử Cu và 1 nguyên tử O. ⇒ Công thức của oxit đồng màu đen là CuO. Bài 5 trang 71 sgk hóa 8: Hãy tìm công thức hóa học của khí A. – Khí A nặng hơn khí hiđro 17 lần. – Thành phần theo khối lượng của khí A là 5,88% H và 94,12% S. Lời giải bài 5 trang 71 sgk hóa 8: – Khối lượng mol của khí A : dA/H2 = 17 ⇒ MA = 17.2 = 34 (g) – Theo bài ra ta có khối lượng mỗi nguyên tố có trong 1 mol khí A: ⇒ mH =(34.5,88)/100 = 2 (g) ⇒ mS = 34 – 2 = 32 (g) Số mol nguyên tử mỗi nguyên tố trong 1 mol khí A là: nH = 2/1 = 2(mol); nS = 32/32 = 1 (mol) Vậy trong 1 mol phân tử chất A có : 2 nguyên tử H và 1 nguyên tử S ⇒ CTHH của khí A là H2S Hy vọng với phần hệ thống lại cách tính theo công thức hóa học với các dạng toán ở trên hữu ích cho các em. Mọi thắc mắc các em hãy để lại bình luận dưới bài viết, và chia sẻ nếu thấy bài viết hay. Chúc các em học tốt! Đăng bởi: thcs Hồng Thái Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường THCS Hồng Thái Hải Phòng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường thcs Hồng Thái (thcshongthaiad.edu.vn)
Nguồn: https://thcshongthaiad.edu.vn
Danh mục: Tra Cứu