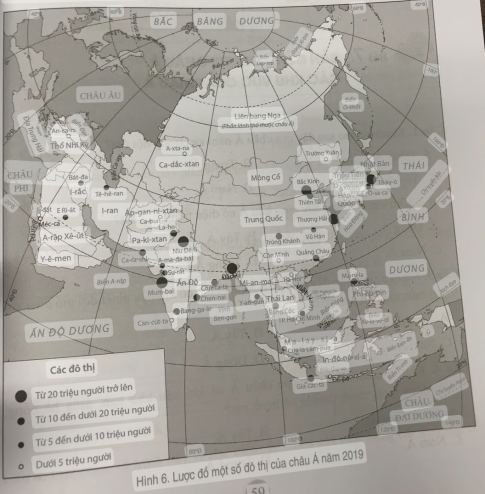
Axit Bazơ Muối và Hidroxit lưỡng tính theo thuyết Arêniut và thuyết Bronsted – hoá 11 bài 2
Qua bài học trước các em đã biết cách phân loại chất điện li mạnh và yếu, đồng thời biết được một số axit bazo và muối như: HCl, HNO3, NaOH, KOH, KCl… là những chất điện li mạnh, còn HF, H2S, HCN,… là những chất điện li yếu.
Bạn đang xem: Axit Bazơ Muối và Hidroxit lưỡng tính theo thuyết Arêniut và thuyết Bronsted – hoá 11 bài 2
Trong bài này chúng ta sẽ tìm hiểu như thế nào là Axit, Bazơ, Muối hay Hidroxit lưỡng tính theo thuyết Arêniut và thuyết Bronsted.
I. Axit là gì, theo thuyết Arêniut và thuyết Bronsted.
Bạn đang xem: Axit Bazơ Muối và Hidroxit lưỡng tính theo thuyết Arêniut và thuyết Bronsted – hoá 11 bài 2
1. Axit là gì
a) Định nghĩa
• Thuyết điện li (Arêniut): Axit là chất khi tan trong nước phân li ra ion H+.
• Thuyết Bronsted: Axit là những chất có khả năng cho proton (ion H+).
b) Axit và bazơ theo quan điểm của Bronsted
• Axit gồm:
+ Các axit vô cơ, hữu cơ: HCl, H2SO4, CH3COOH, (COOH)2 ,…
+ Các kim loại ở dạng hidrat hóa (trừ các ion Na+, K+, Ba2+ và Ca2+): Al(H2O)33+, Cu(H2O)22+ ,…
+ Các ion: H+, NH4+, H3O+, RNH3+, HSO4– ,…
2. Axit nhiều nấc
– Những axit khi tan trong nước mà phân tử điện li nhiều nấc ra ion H+ là các axit nhiều nấc (đa axit), ví dụ:
H3PO4 → H+ + H2PO4–: K1 = 7,6.10-3
H2PO4– → H+ + HPO42- : K2 = 6,2.10-8
HPO42- → H+ + PO43- : K3 = 4,4.10-13
– Phân tử H3PO4 điện li ba nấc ra ion H+, H3PO4 là axit ba nấc.

II. Bazơ là gì, theo thuyết Arêniut và thuyết Bronsted.
1. Bazo là gì?
• Định nghĩa bazo
+ Thuyết điện li (Arêniut) : Bazơ là chất khi tan trong nước phân li ra ion OH–.
+ Thuyết Bronsted: Bazơ là những chất có khả năng nhận proton (nhận H+).
2. Phân loại bazơ
+ Oxit và hiđroxit của kim loại (trừ các oxit và hiđroxit lưỡng tính: Al2O3, Al(OH)3, ZnO, Zn(OH)2…).
+ Các anion gốc axit không mạnh không còn H có thể tách thành ion H+ (CO32-, CH3COO–, S2-, SO32-, C6H5O–…).
+ NH3 và các amin: C6H5NH2, CH3NH2…
III. Chất lưỡng tính là gì? Hirdoxit lưỡng tính là gì?
• Chất lưỡng tính:
+ Thuyết điện li: Chất lưỡng tính là chất trong nước có thể phân li theo cả kiểu axit và kiểu bazơ.
+ Thuyết Bronsted: Chất lưỡng tính là những chất vừa có khả năng cho proton H+, vừa có khả năng nhận proton H+.
• Hidroxit lưỡng tính:
– Hidroxit lưỡng tính là hidro khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazo.
– Ví dụ: Zn(OH)2 là hidroxit lưỡng tính,
° Sự phân li theo kiểu axit: Zn(OH)2 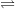 Zn2+ + 2OH–
Zn2+ + 2OH–
° Sự phân li theo kiểu bazo: Zn(OH)2 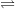 ZnO22- + 2H+
ZnO22- + 2H+
– Để thể hiện tính lưỡng tính của Zn(OH)2 người ta thường viết nó dưới dạng H2ZnO2.
– Các hidroxit lưỡng tính thường gặp là: Zn(OH)2, Al(OH)3, Sn(OH)2, Pb(OH)2, ít tan trong nước và lực axit, lực bazo đều yếu
• Phân loại chất lưỡng tính
– H2O, oxit và hiđroxit lưỡng tính như: ZnO, Zn(OH)2, Al2O3, Al(OH)3, Cr2O3, Cr(OH)3 ,…
– Aminoaxit, muối amoni của axit hữu cơ: R(COOH)x(NH2)y, RCOONH4 ,…
– Anion gốc axit không mạnh vẫn còn khả năng tách H+ như: HCO3–, HS–, HSO3‑, H2PO4–, HPO42-,…
IV. MUỐI
1. Muối là gì?
• Muối là hợp chất, khi tan trong nước điện li ra cation kim loại (hoặc cation ) và anion gốc axit.
– Ví dụ: (NH4)2SO4 → 2NH4+ + SO42-
– Muối mà anion gốc axit không còn hiđro có khả năng điện li ra ion H+ (hiđro có tính axit) được gọi là muối trung hoà.
– Ví dụ: NaCl, (NH4)2SO4, Na2CO3.
Xem thêm : Vũ Ngân Hà là ai? Cựu hoa khôi ĐH Ngoại thương xinh đẹp này là ai?
– Nếu anion gốc axit của muối vẫn còn hiđro có khả năng điện li ra ion H+, thì muối đó được gọi là muối axit.
– Ví dụ: NaHCO3, NaH2PO4, NaHSO4.
– Ngoài ra có một số muối phức tạp thường gặp như muối kép : NaCl.KCl ; KCl.MgCl2.6H2O ;… phức chất: [Ag(NH3)2]Cl ; [Cu(NH3)4]SO4 ;…
2. Sự điện li của muối trong nước
– Hầu hết các muối (kể cả muối kép) khi tan trong nước điện li hoàn toàn ra cation kim loại (hoặc cation ) và anion gốc axit (trừ một số muối như HgCl2, Hg(CN)2 ,… là các chất điện li yếu).
– Ví dụ: K2SO4 → 2K+ + SO42-
NaCl.KCl → Na+ + K+ + 2Cl–
NaHSO3 → Na+ + HSO4–
– Nếu anion gốc axit còn chứa hiđro có tính axit, thì gốc này điện li ra H+.
– Ví dụ: HSO4– → H+ + SO42-
– Phức chất khi tan trong nước điện li hoàn toàn ra ion phức (ion phức nằm trong dấu móc vuông), sau đó ion phức điện li yếu ra các cấu tử thành phần.
– Ví dụ: [Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl–
[Ag(NH3)2]+ → Ag+ + 2NH3
V. Bài tập vận dụng Axit, Bazo, Muối và Hidroxit lưỡng tính
Bài 1 trang 10 sgk hóa 11: Phát biểu các định nghĩa axit, axit một nấc và nhiều nấc, bazơ, hiđroxit lưỡng tính, muối trung hoà, muối axit? Lấy các thí dụ minh hoạ và viết phương trình điện li của chúng.
* Lời giải bài 1 trang 10 sgk hóa 11:
• Axit: là những chất phân li trong nước ra ion H+, ví dụ:
HCl → H+ + Cl–
H2S ⇌ 2H+ + S2-
• Axit một nấc: là những axit chỉ phân li một nấc ra ion H+ thí dụ như HCl, HBr…
HCl → H+ + Cl–
• Axit nhiều nấc là những axit phân li nhiều lần ra H+, ví dụ:
| H2S là axit hai nấc |
H2S ⇔ H+ + HS– HS– ⇌ H+ + S2- |
| H3PO4 là axit ba nấc |
H3PO4 ⇌ H+ + H2PO4– H2PO4– ⇌ H+ + HPO42- HPO42- ⇌ H+ + PO43- |
• Bazơ là những chất khi tan trong nước phân li ra ion OH–
Ba(OH)2 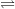 Ba2+ + 2OH–
Ba2+ + 2OH–
• Hiđroxit lưỡng tính: là những chất khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
– Ví dụ: Zn(OH)2, Al(OH)3, Be(OH)2…
+ phân li kiểu bazơ: Al(OH)3 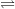 Al3+ + 3OH–
Al3+ + 3OH–
+ phân li kiểu axit: HAlO2 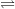 AlO2– + H+
AlO2– + H+
(Khi đó: Al(OH)3 viết dưới dạng axit HAlO2.H2O)
• Muối trung hoà: là những muối mà phân tử không còn khả năng phân li ra ion H+
– Ví dụ: NaCl, K2SO4, NaHPO3, CaCO3, Al(NO3)3 ,…
Al(NO3)3 → Al3+ + 3NO3–
• Muối axit: là muối mà trong phân tử vẫn còn hiđro có khả năng phân li ra ion H+
– Ví dụ: NaHSO4, NaHCO3, KH2PO4, K2HPO2 ,…
NaHSO4 → Na+ + HSO4–
– Gốc axit HSO4– lại phân li ra H+
HSO4– 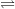 H+ + SO42-
H+ + SO42-
Bài 2 trang 10 sgk hóa 11: Viết phương trình điện li của các chất sau:
a) Các axit yếu H2S; H2CO3
b) Bazơ mạnh: LiOH
c) Các muối: K2CO3, NaClO, NaHS
d) Hiđroxit lưỡng tính: Sn(OH)2
* Lời giải bài 2 trang 10 sgk hóa 11:
a) Các axit yếu H2S; H2CO3:
H2S 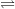 H+ + HS–
H+ + HS–
HS– 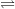 H+ + S2-
H+ + S2-
Xem thêm : 99+ Hình ảnh Lisa cute, Ảnh lisa đẹp nhất của Blackpink
H2CO3 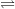 H+ + HCO3–
H+ + HCO3–
HCO3– 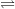 H+ + CO32-
H+ + CO32-
b) Bazơ mạnh LiOH
LiOH → Li+ + OH–
c) Các muối K2CO3, NaClO, NaHS
K2CO3 → 2K+ + CO32-
NaClO → Na+ + ClO–
NaHS → Na+ + HS–
HS– 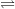 H+ + S2-
H+ + S2-
d) Hiđroxit lưỡng tính Sn(OH)2:
Sn(OH)2 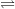 Sn2+ + 2OH–
Sn2+ + 2OH–
Hoặc H2SnO2 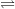 2H+ + SnO22-
2H+ + SnO22-
Bài 3 trang 10 sgk hóa 11: Theo thuyết A-re-ni-ut, kết luận nào sau đây đúng?
A. Một hợp chất trong thành phần phân tử có hiđro là một axit.
B. Một hợp chất trong thành phần phân tử có nhóm OH là bazơ.
C. Một hợp chất có khả năng phân li ra cation H+ trong nước là axit.
D. Một bazơ không nhất thiết phải có nhóm OH trong thành phần phân tử.
* Lời giải bài 3 trang 10 sgk hóa 11:
– Đáp án: C. Một hợp chất có khả năngphân li ra cation H+ trong nước là axit.
A. Sai vì: axit là chất khi tan trong nước phân li ra H+( định nghĩa theo thuyết A-re-ni-ut). Nhiều chất trong phân tử có Hidro nhưng phải axit như: H2O, NH3,…
B. Sai vì: các hidroxit lưỡng tính trong thành phần phân tử cũng có nhóm OH: Zn(OH)2, Al(OH)3,…
D. Sai vì: Bazơ là chất khi tan trong nước phân li ra anion OH–, nên trong phân tử bazơ luôn có nhóm OH (định nghĩa theo thuyết A-rê-ni-ut).
Bài 4 trang 10 sgk hóa 11: Với dung dịch axit yếu CH3COOH 0,10M, nếu bỏ qua sự điện li của nước, thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M
B. [H+] < [CH3COO–]
C. [H+] > [CH3COO–]
D. [H+] < 0,10M
* Lời giải bài 4 trang 10 sgk hóa 11:
– Đáp án: D. [H+ ] < 0,10M
– Do CH3COOH là chất điện li yếu nên trong nước chỉ phân li một phần: CH3COOH 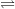 H+ + CH3COO–
H+ + CH3COO–
⇒ [H+] < [CH3COO–]= 0,1M
Bài 5 trang 10 sgk hóa 11: Đối với dung dịch axit mạnh HNO3 0,10M nếu bỏ qua sự điện li của nước, thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M
B. [H+] < [NO3–]
C. [H+] < [NO3–]
D. [H+] < 0,10M
* Lời giải bài 5 trang 10 sgk hóa 11:
– Đáp án: A. [H+ ] = 0,10M
– Do HNO3 là chất điện li mạnh nên nó phân li hoàn toàn trong dung dịch:
HNO3 → H+ + NO3–
0,1 0,1 0,1 (M)
⇒ [H+ ] = [NO3– ] = 0,1M
Hy vọng với bài viết về Axit Bazơ Muối và Hidroxit lưỡng tính theo thuyết Arêniut và thuyết Bronsted ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
|
¤ Các bài viết cùng chương 1: » Bài 6: Bài Thực Hành 1: Tính Axit-Bazơ. Phản Ứng Trao Đổi Ion Trong Dung Dịch Các Chất Điện Li ¤ Có thể bạn muốn xem: |
Đăng bởi: thcs Hồng Thái
Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường THCS Hồng Thái Hải Phòng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường thcs Hồng Thái (thcshongthaiad.edu.vn)
Nguồn: https://thcshongthaiad.edu.vn
Danh mục: Tra Cứu