Hóa 11 bài 3: Sự điện li của nước, nồng độ pH, Chất chỉ thị Axit Bazo
- Thơ thiên nhiên trong Ức Trai thi tập và Quốc âm thi tập của Nguyễn Trãi
- Giải câu 2 bài ôn tập phép cộng và phép trừ hai phân số | sgk Toán lớp 5
- Dàn ý Giải thích câu tục ngữ Lời nói gói vàng
- https://tech12h.com/de-bai/cho-ba-so-6-8-24.html
- Phạm Đình Thái Ngân là ai? Tiểu sử của nam ca sĩ Phạm Đình Thái Ngân
Hóa 11 bài 3: Sự điện li của nước, nồng độ pH, Chất chỉ thị Axit Bazo. Trong bài học trước các em đã biết về chất điện li mạnh là chất khi tan trong nước các phân tử hòa tan đều phân li ra ion, còn chất điện li yếu thì chỉ có một số phần tử hòa tan phân li ra ion.
Bạn đang xem: Hóa 11 bài 3: Sự điện li của nước, nồng độ pH, Chất chỉ thị Axit Bazo
Vậy nước có phải là chất điện li hay không? sự điện li của nước là mạnh hay yếu? nồng độ pH là gì? chất chỉ thị màu axit bazơ có công dụng gì? chúng ta cùng tìm hiểu qua bài viết dưới đây.
I. Nước là chất điện li yếu
1. Sự điện li của nước
– Nước điện li rất yếu theo phương trình sau:
H2O 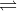 H+ + OH–
H+ + OH–
2. Tích số ion của nước
– Môi trường trung tính là môi trường có: [H+] = [OH–]
– Bằng thực nghiệm, ở 250C, người ta xác định được trong nước nguyên chất: [H+] = [OH–] = 1,0.10-7 M.
– Đặt: KH2O = [H+] . [OH–] = 1,0.10-7 . 1,0.10-7 = 1,0.10-14
– KH2O được gọi tích số ion của nước. Tích số này là hằng số ở nhiệt độ xác định (không khác nhiều với 250C). Một cách gần đúng, tích số này là cũng là hằng số cả trong những dung dịch loãng của các chất khác nhau.

3. Ý nghĩa tích số ion của nước
a) Môi trường axit
– Khi cho axit HCl vào nước, nồng độ H+ tăng, mà tích số ion trong nước không đổi nên nồng độ OH– phải giảm.
* Ví dụ: Tính [H+] và [OH–] của dung dịch HCl 10-3M.
° Lời giải:
– Ta có pt điện li:
HCl → H+ + Cl–
10-3M → 10-3M
⇒ [H+] = [HCl] = 10-3M. vì [H+].[OH–]=1,0.10-14 nên
⇒ ![]()
⇒ [H+]>[OH–] hay [H+] > 10-7M.
– Vậy môi trường axit là môi trường có: [H+]>[OH–] hay [H+]>1,0.10-7M
b) Môi trường kiềm
– Khi cho NaOH vào nước, nồng độ OH– tăng, mà tích số ion trong nước không đổi nên nồng độ H+ phải giảm.
* Ví dụ: Tính [H+] và [OH–] của dung dịch NaOH 10-5M.
° Lời giải:
– Ta có pt điện li:
NaOH → Na+ + OH–
10-5M → 10-5M
⇒ [OH–] = [NaOH] = 10-5M. vì [H+].[OH–]=1,0.10-14 nên
![]()
⇒ [OH–]>[H+]
– Vậy môi trường kiềm là môi trường có: [H+]<[OH–] hay [H+]<1,0.10-7M
Xem thêm : Đoạn văn tiếng Anh về cuộc sống trong tương lai (11 mẫu)
• Kết luận:
– Môi trường trung tính: [H+] = 1,0.10-7M
– Môi trường axit: [H+] < 1,0.10-7M
– Môi trường kiềm: [H+] > 1,0.10-7M
II. Khái niệm nồng độ pH, chất chỉ thị axit – bazơ
1. Khái niệm về nồng độ pH
– Có thể đánh giá độ axit và độ kiềm của dung dịch bằng nồng độ [H+].
– Để tránh ghi nồng độ [H+] với số mũ âm, người ta dùng gía trị pH với quy ước:
pH = – lg[H+] ; [H+] = 10– pHM.
Nếu [H+] = 10-aM thì pH = a.
* Ví dụ: [H+] = 1,0.10-5M ⇒ pH=5,00: môi trường axit
[H+] = 1,0.10-7M ⇒ pH=7,00: môi trường trung tính
[H+] = 1,0.10-9M ⇒ pH=9,00: môi trường kiềm
* Như vậy, ta có:
pH = 7: môi trường trung tính.
pH < 7: môi trường axit.
pH > 7: môi trường kiềm.
– Thang pH thường dùng có giá trị từ 1 đến 14.
2. Chất chỉ thị axit – bazơ
– Chất chỉ thị axit – bazơ là chất có màu biến đổi phụ thuộc theo giá trị pH của dung dịch.
 màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau
màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau
– Khi trộn lẫn một số chất chỉ thị axit – bazơ có màu biến đổi kế tiếp nhau theo giá trị pH ta thu được chất chỉ thị vạn năng.
 Màu của chất chỉ thị vạn năng (thuốc thử MERCK của Đức) ở các giá trị pH khác nhau
Màu của chất chỉ thị vạn năng (thuốc thử MERCK của Đức) ở các giá trị pH khác nhau
– Để xác định tương đối chính xác giá trị pH của dung dịch, người ta dùng máy đo pH.
Bạn đang xem: Hóa 11 bài 3: Sự điện li của nước, nồng độ pH, Chất chỉ thị Axit Bazo
III. Bài tập về sự điện li của nước ph chất chỉ thị axit bazơ
* Bài 1 trang 14 SGK Hóa 11: Tích số ion của nước là gì và bằng bao nhiêu ở 25oC?
° Lời giải bài 1 trang 14 SGK Hóa 11:
– Tích số ion của nước là tích số của nồng độ H+ và nồng độ OH– (viết là: [H+][OH–]) trong nước và cả trong các dung dịch loãng của các chất khác nhau.
– Ở 25oC bằng thực nghiệm, người ta xác định được [H+] = [OH–] = 10-7(M).
⇒ Vậy tích số ion của nước (ở 25oC) là [H+][OH–] = 10-14.
* Bài 2 trang 14 SGK Hóa 11: Phát biểu định nghĩa môi trường axit, trung tính và kiềm theo nồng độ H+ và pH?
° Lời giải bài 2 trang 14 SGK Hóa 11:
– Môi trường axit là môi trường trong đó [H+] > [OH–] hay [H+] > 10-7(M) hoặc pH<7.
– Môi trường trung tính là môi trường trong đó [H+] = [OH–] = 10-7(M) hoặc pH=7.
– Môi trường kiềm là môi trường trong đó [H+] < [OH–] hay [H+] < 10-7(M) hoặc pH>7.
* Bài 3 trang 14 SGK Hóa 11: Chất chỉ thị axit – bazơ là gì? Hãy cho biết màu của quỳ tím và phenolphtalein trong các khoảng pH khác nhau?
Xem thêm : Giải SBT bài 10: Mưa | SBT Địa lí 10
° Lời giải bài 3 trang 14 SGK Hóa 11:
– Chất chỉ thị axit – bazơ là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
– Màu của quỳ tím trong các khoảng pH khác nhau:
| pH | pH ≤ 6 | 6 < pH < 8 | pH ≥ 8 |
| Quỳ | Đỏ | Tím | Xanh |
– Màu của phenolphtalien trong các khoảng pH khác nhau:
| pH | pH < 8,3 | 8,3 ≤ pH ≤ 10 |
| Phenolphtalien | Không màu | Hồng |
* Bài 4 trang 14 SGK Hóa 11: Một dung dịch có [OH– ]= 1,5.10-5. Môi trường của dung dịch này là:
A. Axit; B. Trung tính; C. Kiềm; D. Không xác định được.
° Lời giải bài 4 trang 14 SGK Hóa 11:
• Chọn đáp án: C. Kiềm;
– Theo bài ra [OH–]= 1,5.10-5 (M) mà [H+].[OH–] = 10-14, suy ra:
![]()
⇒ [H+]<10-7M nên môi trường của dung dịch là kiềm.
* Bài 5 trang 14 SGK Hóa 11: Tính nồng độ H+, OH– và pH của dung dịch HCl 0,10M và dung dịch NaOH 0,010M?
° Lời giải bài 5 trang 14 SGK Hóa 11:
– Với dd HCl 0,10M, ta có pt điện li:
HCl → H+ + Cl–
0,1M → 0,1M 0,1M
⇒ [H+] = [HCl] = 0,1M = 10-1M ⇒ pH = 1.
– Với dd NaOH 0,01M =10-2M , ta có pt điện li:
NaOH → Na+ + OH–
10-2M → 10-2M 10-2M
⇒ [OH–] = [NaOH] = 10-2M. vì [H+].[OH–]=1,0.10-14 nên
![]() ⇒ pH = 2.
⇒ pH = 2.
* Bài 6 trang 14 SGK Hóa 11: Dung dịch HCl 0,010M, tích số ion của nước là:
A. [H+][OH– ] > 1,0.10-14 ;
B. [H+ ][OH– ] = 1,0.10-14;
C. [H+][OH– ] < 1,0.10-14 ;
D. Không xác định được
° Lời giải bài 6 trang 14 SGK Hóa 11:
• Chọn đáp án: B. [H+ ][OH– ] = 1,0.10-14
– Vì tích số ion của nước là hằng số trong nước và cả trong các dung dịch loãng của các chất khác nhau.
Hy vọng với bài viết về sự điện ly của nước, pH và chất chỉ thị màu axit, bazo ở trên giúp các em nắm vững khối kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại dưới phần bình luận để thcs Hồng Thái ghi nhận và hỗ trợ nhé. chúc các em học tốt.
Đăng bởi: thcs Hồng Thái
Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường THCS Hồng Thái Hải Phòng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường thcs Hồng Thái (thcshongthaiad.edu.vn)
Nguồn: https://thcshongthaiad.edu.vn
Danh mục: Tra Cứu

