Hóa 8 bài 38: Axit, Bazơ, Muối và Nước: Bài tập luyện tập về Axit Bazơ Muối
- Em hãy viết một đoạn văn ngắn khoảng 100 từ nói về tác dụng của việc trồng cây xanh ở các công viên.
- How to Make Roast Pork with Rice Cooker
- Công thức tính diện tích hình thoi
- Giải SBT bài 28 Vai trò, đặc điểm, cơ cấu ngành công nghiệp, các nhân tố ảnh hưởng tới sự phát triển và sự phân công nghiệp | SBT địa lí 10 kết nối tri thức
- Cho biết trong hai câu sau đây, trường hợp nào hỗn hợp được dùng như một thuật ngữ, trường hợp nào hỗn hợp được dùng như một từ thông thường | văn 9 tập 1
Hóa 8 bài 38: Axit, Bazơ, Muối và Nước: Bài tập luyện tập về Axit Bazơ Muối. Axit Bazơ Muối và Nước là những hợp chất phổ biến chúng ta gặp thường xuyên và xuyên suốt môn hóa học bậc THCS, THPT.
Bạn đang xem: Hóa 8 bài 38: Axit, Bazơ, Muối và Nước: Bài tập luyện tập về Axit Bazơ Muối
Bài này chúng ta sẽ hệ thống lại thành phần, tính chất của nước; định nghĩa, công thức, phân loại và cách gọi tên của axit, bazơ và muối.
I. Axit, bazơ, muối và nước: kiến thức cần nhớ
1. Thành phần hóa học định tính của nước: gồm hiđro và oxi
Tỉ lệ về khối lượng: 1 phần H và 8 phần O
2. Tính chất của Nước:
– Nước tác dụng với một số kim loại ở nhiệt độ thường (như Na, K, Ca,…) tạo thành bazơ tan và khí hiđro;
– Nước tác dụng với một số oxit kim loại tạo thành bazơ tan như NaOH, KOH, Ca(OH)2;
– Nước tác dụng với một số oxit phi kim tạo ra axit như H2SO3, H2SO4
3. Phân tử axit gồm có 1 hay nhiều nguyên tử hiđro liên kết với gốc axit.
Công thức hóa học của axit gồm H và gốc axit.
4. Phân tử bazơ gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (-OH)
Công thức hóa học của bazơ gồm 1 nguyên tử kim loại và một số nhóm -OH.
Tên bazơ = tên kim loại (thêm hóa trị nếu kim loại có nhiều hóa trị ) + hiđroxit
5. Phân tử muối gồm có nguyên tử kim loại liên kết với gốc axit.
Công thức hóa học của muối gồm kim loại và gốc axit.
Tên muối = tên kim loại (thêm hóa trị nếu kim loại có nhiều hóa trị )+ tên gốc axit.
II. Bài tập luyện tập: Axit, Bazơ, Muối và Nước
* Bài 1 trang 131 SGK Hóa 8: Tương tự như natri, các kim loại kali K và canxi Ca cũng tác dụng được với nước tạo thành bazơ tan và giải phóng khí hiđro.
a) Hãy viết các phương trình phản ứng xảy ra.
b) Các phản ứng hóa học trên thuộc loại phản ứng hóa học nào?
Xem thêm : Cách chơi Roblox miễn phí trên trình duyệt web
* Lời giải:
a) Phương trình phản ứng xảy ra là:
2K + 2H2O → 2KOH + H2.
Ca + 2H2O → Ca(OH)2 + H2.
b) Các phản ứng trên thuộc loại phản ứng oxi hóa – khử.
* Bài 2 trang 132 SGK Hóa 8: Hãy lập phương trình hóa học của những phản ứng có sơ đồ sau đây:
a) Na2O + H2O → NaOH.
K2O + H2O → KOH.
b) SO2 + H2O → H2SO3.
SO3 + H2O → H2SO4.
N2O5 + H2O → HNO3.
c) NaOH + HCl → NaCl + H2O.
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O.
d) Chỉ ra loại chất tạo thành ở a), b), c) là gì? Nguyên nhân có sự khác nhau ở a) và b)
e) Gọi tên các chất tạo thành.
Xem thêm : Cách chơi Roblox miễn phí trên trình duyệt web
* Lời giải:
Phương trình hóa học của phản ứng:
a) Na2O + H2O→ 2NaOH. (Natri hiđroxit)
K2O + H2O → 2KOH (kali hidroxit)
b) SO2 + H2O → H2SO3. (Axit sunfurơ)
SO3 + H2O → H2SO4. (Axit sunfuric)
N2O5 + H2O → 2HNO3. (Axit nitric)
c) NaOH + HCl → NaCl + H2O. (Natri clorua)
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O. (Nhôm sunfat)
d) Loại chất tạo thành ở a) (NaOH, KOH) là bazơ
Chất tan ở b) (H2SO4, H2SO3, HNO3) là axit
Chất tạo ra ở c(NaCl, Al2(SO4)3 là muối.
Nguyên nhân của sự khác biệt là ở câu a) và câu b: oxit bazơ tác dụng với nước tạo bazơ; còn oxit của phi kim tác dụng với nước tạo ra axit
e) Gọi tên sản phẩm
NaOH: natri hiđroxit
KOH: kali hiđroxit
H2SO3: axit sunfurơ
H2SO4: axit sunfuric
HNO3: axit nitric
NaCl: natri clorua
Al2(SO4)3: nhôm sunfat
* Bài 3 trang 132 SGK Hóa 8: Viết công thức hóa học của những muối có tên gọi dưới đây:
Đồng (II) clorua, kẽm sunfat, sắt (III) sunfat, magie Hiđrocacbonat, canxi photphat, natri hiđrophotphat, natri đihiđrophotphat.
Xem thêm : Cách chơi Roblox miễn phí trên trình duyệt web
* Lời giải:
Công thức hóa học của những muối:
Đồng (II) clorua: CuCl2,
Kẽm sunfat: ZnSO4,
Sắt (III) sunfat: Fe2(SO4)3,
Magie Hiđrocacbonat: Mg(HCO3)2,
Canxi photphat: Ca3(PO4)2,
Natri hiđrophotphat: Na2HPO4,
Natri đihiđrophotphat: NaH2PO4.
* Bài 4 trang 132 SGK Hóa 8: Cho biết khối lượng mol của một oxit kim loại là 160gam, thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hóa học của oxit. Gọi tên oxit kim loại đó.
Xem thêm : Cách chơi Roblox miễn phí trên trình duyệt web
* Lời giải:
– Gọi công thức của oxit kim loại là MxOy
– Vì thành phần kim loại trong oxit là 70% nên ta có:
%mO = 100% – 70% = 30%
Xem thêm : Hãy chỉ ra các bộ phận của la bàn trong hình dưới đây.
⇒ mO = 12y = 160.30% = 48
⇒ 16y = 48 = y = 3
mM = 160.70% = 112g
⇒ MKL.x = 112 (với MKL là phân tử khối của kim loại M)
– Gọi a là hóa trị của kim loại (với a = 1; 2; 3)
Theo quy tắc hóa trị thì a.x = 2.3 = 6
Nếu a = 1 ⇒ x = 6 (loại vì khi đó x/y = 6/3 chưa tối giản)
Nếu a = 2 ⇒ x = 3 (loại vì khi đó x/y = 3/3 chưa tối giản)
Nếu a = 3 ⇒ x = 2 (nhận vì khi đó x/y = 2/3 tối giản)
và suy ra: M = 112/2 = 56 ≡ Fe
Vậy CTHH: Fe2O3, đó là sắt (III) oxit.
* Bài 5 trang 132 SGK Hóa 8: Nhôm (III) oxit tác dụng với axit sunfuric theo phương trình phản ứng sau:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tính lượng muối nhôm sunfat được tạo thành nếu đã sử dụng 49g axit sunfuric nguyên chất tác dụng với 60g nhôm oxit. Sau phản ứng chất nào còn dư ? Lượng dư của chất đó là bao nhiêu ?
Xem thêm : Cách chơi Roblox miễn phí trên trình duyệt web
* Lời giải:
Phương trình hóa học của phản ứng:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
1mol 3mol 1mol 3mol
Theo bài ra, ta có:
![]()
![]()
So sánh tỉ lệ số mol Al2O3 và H2SO4 theo số mol bài cho trên số mol theo tỉ lệ phản ứng ta có:
![]()
→ Vậy Al2O3 dư, H2SO4 hết. Số mol sản phẩm thu được tính theo số mol H2SO4.
– Theo PTHH có số mol nhôm sunfat là: 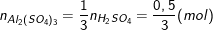
Nên khối lượng nhôm sunfat là: 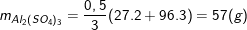
– Số mol nhôm oxit tham gia phản ứng là:
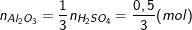
Nên khối lượng nhôm oxit tham gia pư là:
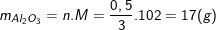
Vậy khối lượng nhôm oxit dư là: mAl2O3 (dư) = 60 – 17 = 43(g).
Như vậy, với nội dung bài tập luyện tập: Axit, bazo, muối và nước về tính chất, phân loại, tên gọi ở trên hy vọng giúp các em nắm vững khối kiến thức này hơn. Mọi thắc mắc và góp ý các em hãy để lại bình luận dưới bài viết để thcs Hồng Thái ghi nhận và hỗ trợ, chúc các em học tốt.
Đăng bởi: thcs Hồng Thái
Chuyên mục: Giáo Dục
Hóa 8 bài 38
Hóa 8 bài 38: Axit, Bazơ, Muối và Nước: Bài tập luyện tập về Axit Bazơ Muối. Axit Bazơ Muối và Nước là những hợp chất phổ biến chúng ta gặp thường xuyên và xuyên suốt môn hóa học bậc THCS, THPT. Bài này chúng ta sẽ hệ thống lại thành phần, tính chất của nước; định nghĩa, công thức, phân loại và cách gọi tên của axit, bazơ và muối. I. Axit, bazơ, muối và nước: kiến thức cần nhớ 1. Thành phần hóa học định tính của nước: gồm hiđro và oxi Tỉ lệ về khối lượng: 1 phần H và 8 phần O 2. Tính chất của Nước: – Nước tác dụng với một số kim loại ở nhiệt độ thường (như Na, K, Ca,…) tạo thành bazơ tan và khí hiđro; – Nước tác dụng với một số oxit kim loại tạo thành bazơ tan như NaOH, KOH, Ca(OH)2; – Nước tác dụng với một số oxit phi kim tạo ra axit như H2SO3, H2SO4 3. Phân tử axit gồm có 1 hay nhiều nguyên tử hiđro liên kết với gốc axit. Công thức hóa học của axit gồm H và gốc axit. 4. Phân tử bazơ gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (-OH) Công thức hóa học của bazơ gồm 1 nguyên tử kim loại và một số nhóm -OH. Tên bazơ = tên kim loại (thêm hóa trị nếu kim loại có nhiều hóa trị ) + hiđroxit 5. Phân tử muối gồm có nguyên tử kim loại liên kết với gốc axit. Công thức hóa học của muối gồm kim loại và gốc axit. Tên muối = tên kim loại (thêm hóa trị nếu kim loại có nhiều hóa trị )+ tên gốc axit. II. Bài tập luyện tập: Axit, Bazơ, Muối và Nước * Bài 1 trang 131 SGK Hóa 8: Tương tự như natri, các kim loại kali K và canxi Ca cũng tác dụng được với nước tạo thành bazơ tan và giải phóng khí hiđro. a) Hãy viết các phương trình phản ứng xảy ra. b) Các phản ứng hóa học trên thuộc loại phản ứng hóa học nào? * Lời giải: a) Phương trình phản ứng xảy ra là: 2K + 2H2O → 2KOH + H2. Ca + 2H2O → Ca(OH)2 + H2. b) Các phản ứng trên thuộc loại phản ứng oxi hóa – khử. * Bài 2 trang 132 SGK Hóa 8: Hãy lập phương trình hóa học của những phản ứng có sơ đồ sau đây: a) Na2O + H2O → NaOH. K2O + H2O → KOH. b) SO2 + H2O → H2SO3. SO3 + H2O → H2SO4. N2O5 + H2O → HNO3. c) NaOH + HCl → NaCl + H2O. Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O. d) Chỉ ra loại chất tạo thành ở a), b), c) là gì? Nguyên nhân có sự khác nhau ở a) và b) e) Gọi tên các chất tạo thành. * Lời giải: Phương trình hóa học của phản ứng: a) Na2O + H2O→ 2NaOH. (Natri hiđroxit) K2O + H2O → 2KOH (kali hidroxit) b) SO2 + H2O → H2SO3. (Axit sunfurơ) SO3 + H2O → H2SO4. (Axit sunfuric) N2O5 + H2O → 2HNO3. (Axit nitric) c) NaOH + HCl → NaCl + H2O. (Natri clorua) 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O. (Nhôm sunfat) d) Loại chất tạo thành ở a) (NaOH, KOH) là bazơ Chất tan ở b) (H2SO4, H2SO3, HNO3) là axit Chất tạo ra ở c(NaCl, Al2(SO4)3 là muối. Nguyên nhân của sự khác biệt là ở câu a) và câu b: oxit bazơ tác dụng với nước tạo bazơ; còn oxit của phi kim tác dụng với nước tạo ra axit e) Gọi tên sản phẩm NaOH: natri hiđroxit KOH: kali hiđroxit H2SO3: axit sunfurơ H2SO4: axit sunfuric HNO3: axit nitric NaCl: natri clorua Al2(SO4)3: nhôm sunfat * Bài 3 trang 132 SGK Hóa 8: Viết công thức hóa học của những muối có tên gọi dưới đây: Đồng (II) clorua, kẽm sunfat, sắt (III) sunfat, magie Hiđrocacbonat, canxi photphat, natri hiđrophotphat, natri đihiđrophotphat. * Lời giải: Công thức hóa học của những muối: Đồng (II) clorua: CuCl2, Kẽm sunfat: ZnSO4, Sắt (III) sunfat: Fe2(SO4)3, Magie Hiđrocacbonat: Mg(HCO3)2, Canxi photphat: Ca3(PO4)2, Natri hiđrophotphat: Na2HPO4, Natri đihiđrophotphat: NaH2PO4. * Bài 4 trang 132 SGK Hóa 8: Cho biết khối lượng mol của một oxit kim loại là 160gam, thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hóa học của oxit. Gọi tên oxit kim loại đó. * Lời giải: – Gọi công thức của oxit kim loại là MxOy – Vì thành phần kim loại trong oxit là 70% nên ta có: %mO = 100% – 70% = 30% ⇒ mO = 12y = 160.30% = 48 ⇒ 16y = 48 = y = 3 mM = 160.70% = 112g ⇒ MKL.x = 112 (với MKL là phân tử khối của kim loại M) – Gọi a là hóa trị của kim loại (với a = 1; 2; 3) Theo quy tắc hóa trị thì a.x = 2.3 = 6 Nếu a = 1 ⇒ x = 6 (loại vì khi đó x/y = 6/3 chưa tối giản) Nếu a = 2 ⇒ x = 3 (loại vì khi đó x/y = 3/3 chưa tối giản) Nếu a = 3 ⇒ x = 2 (nhận vì khi đó x/y = 2/3 tối giản) và suy ra: M = 112/2 = 56 ≡ Fe Vậy CTHH: Fe2O3, đó là sắt (III) oxit. * Bài 5 trang 132 SGK Hóa 8: Nhôm (III) oxit tác dụng với axit sunfuric theo phương trình phản ứng sau: Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O Tính lượng muối nhôm sunfat được tạo thành nếu đã sử dụng 49g axit sunfuric nguyên chất tác dụng với 60g nhôm oxit. Sau phản ứng chất nào còn dư ? Lượng dư của chất đó là bao nhiêu ? * Lời giải: Phương trình hóa học của phản ứng: Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O 1mol 3mol 1mol 3mol Theo bài ra, ta có: So sánh tỉ lệ số mol Al2O3 và H2SO4 theo số mol bài cho trên số mol theo tỉ lệ phản ứng ta có: → Vậy Al2O3 dư, H2SO4 hết. Số mol sản phẩm thu được tính theo số mol H2SO4. – Theo PTHH có số mol nhôm sunfat là: Nên khối lượng nhôm sunfat là: – Số mol nhôm oxit tham gia phản ứng là: Nên khối lượng nhôm oxit tham gia pư là: Vậy khối lượng nhôm oxit dư là: mAl2O3 (dư) = 60 – 17 = 43(g). Như vậy, với nội dung bài tập luyện tập: Axit, bazo, muối và nước về tính chất, phân loại, tên gọi ở trên hy vọng giúp các em nắm vững khối kiến thức này hơn. Mọi thắc mắc và góp ý các em hãy để lại bình luận dưới bài viết để thcs Hồng Thái ghi nhận và hỗ trợ, chúc các em học tốt. Đăng bởi: thcs Hồng Thái Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường THCS Hồng Thái Hải Phòng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường thcs Hồng Thái (thcshongthaiad.edu.vn)
Nguồn: https://thcshongthaiad.edu.vn
Danh mục: Tra Cứu
