Hóa 11 bài 21: Cách lập công thức phân tử (CTPT) hợp chất hữu cơ

- Hiệu ứng Domino là gì? Cách áp dụng hiệu ứng Domino hiệu quả
- Hé lộ ý nghĩa tên Tú Anh và những thú vị tên này tiếng nước ngoài
- Cảm nhận của em về hai khổ thơ đầu bài Đây thôn Vĩ Dạ
- Giải SBT bài 20: Việt Nam thời Lê sơ | SBT Lịch sử và Địa lí 7 cánh diều
- Ý nghĩa tên Linh nói chung & gợi ý tên đệm, biệt danh hay
Hóa 11 bài 21: Cách lập công thức phân tử (CTPT) hợp chất hữu cơ. Hợp chất hữu cơ thường gồm có nguyên tố cacbon và các nguyên tố khác như hiđro, oxi,… vậy từ các nguyên tố này làm sao ta có thể xác định hay thiết lập được công thức phân tử của các hợp chất hữu cơ?
Bạn đang xem: Hóa 11 bài 21: Cách lập công thức phân tử (CTPT) hợp chất hữu cơ
Để giải đáp câu hỏi trên chúng ta cùng đi tìm hiểu cách xác định công thức phân tử (CTPT) đơn giản nhất của hợp chất hữu cơ. Qua đó, thiết lập công thức phân tử của hợp chất, đồng thời giải một số bài tập về lập công thức phân tử để hiểu rõ hơn nội dung lý thuyết qua bài viết dưới đây.
I. Công thức đơn giản nhất
1. Định nghĩa
– Công thức đơn giản nhất là công thức biểu thị tỉ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử.
2. Cách thiết lập công thức đơn giản nhất
• Thiết lập công thức đơn giản nhất của hợp chất hữu cơ CxHyOz là tìm tỉ lệ:
– Theo khối lượng: 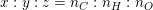
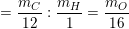
– Theo tỉ lệ phần trăm: ![]()
* Ví dụ: Kết quả phân tích nguyên tố hợp chất X cho biết %C = 40,00%; %H = 6,67%, còn lại là oxi. Lập công thức đơn giản nhất của X.
° Lời giải:
– Gọi công thức phân tử của X là CxHyOz (x, y, z nguyên dương).
– Từ kết quả phân tích định lượng, lập được hệ thức:
![]()
![]()
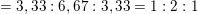
⇒ Công thức đơn giản nhất của X là CH2O.
II. Công thức phân tử
1. Định nghĩa
Bạn đang xem: Hóa 11 bài 21: Cách lập công thức phân tử (CTPT) hợp chất hữu cơ
– Công thức phân tử là công thức biểu thị số lượng nguyên tử của mỗi nguyên tố trong phân tử.
2. Quan hệ giữa công thức phân tử và công thức đơn giản nhất
* Ví dụ về CTPT và công thức đơn giản nhất:
| Hợp chất | Công thức phân tử | Công thức đơn giản nhất |
| Metan | CH4 | CH4 |
| Etilen | C2H4 | CH2 |
| Ancol etylic | C2H6O | C2H6O |
| Axit axetic | C2H4O2 | CH2O |
| Glucozơ | C6H12O6 | CH2O |
– Số nguyên tử của mỗi nguyên tố trong công thức phân tử là số nguyên lần số nguyên tử của nó trong công thức đơn giản nhất.
– Trong nhiều trường hợp, công thức phân tử cũng chính là công thức đơn giản nhất như: Ancol etylic C2H6O, metan CH4,…
– Một số chất có công thức phân tử khác nhau nhưng có cùng một công thức đơn giản nhất như: Axetilen C2H2 và benzen C6H6; axit axetic C2H4O2 và glucozơ C6H12O6,…
3. Cách thiết lập công thức phân tử hợp chất hữu cơ
a) Lập công thức phân tử (CTPT) dựa vào thành phần phần trăm khối lượng các nguyên tố
Xét sơ đồ: CxHyOz → xC + yH + zO
Khối lượng: M (g) 12.x 1.y 16.z (g)
Thành phần phần trăm khối lượng:
100% %C % H % O
Từ tỉ lệ thức: ![]()
Suy ra: 
* Ví dụ: Phenolphtalein – chất chỉ thị màu dùng nhận biết dung dịch bazơ – có phần trăm khối lượng C, H và O lần lượt bằng 75,47%, 4,35% và 20,18%. Khối lượng mol phân tử của phenolphtalein bằng 318,0 g/mol. Hãy lập công thức phân tử của phenolphtalein.
° Lời giải
– Ta thấy %C + %H + %O = 100%
⇒ Thành phần phân tử phenolphtalein gồm ba nguyên tố C, H, O nên ta đặt công thức phân tử là CxHyOz (với x, y, z nguyên dương).
– Theo bài ra, ta có:
![]()
![]()
![]()
⇒ Công thức phân tử của phenolphtalein là C20H14O4.
b) Lập công thức phân tử (CTPT) thông qua công thức đơn giản nhất
* Ví dụ: Chất hữu cơ X có công thức đơn giản nhất CH2O và có khối lượng mol phân tử bằng 60,0 g/mol. Xác định công thức phân tử của X.
° Lời giải
– Công thức phân tử của X là (CH2O)n hay CnH2nOn.
– Theo bài ra: MX = (12 + 2.1 + 16).n = 60 ⇔ 30n = 60 ⇒ n = 2.
Xem thêm : Khối K là gì? Gồm những môn nào, xét ngành nào, trường nào?
– Vậy X có công thức phân tử C2H4O2.
c) Lập công thức phân tử (CTPT) bằng cách tính trực tiếp theo khối lượng sản phẩm đốt cháy
* Ví dụ: Hợp chất Y chứa các nguyên tố C, H, O. Đốt cháy hoàn toàn 0,88 gam Y thu được 1,76 gam CO2 và 0,72 gam H2O. Tỉ khối hơi của Y so với không khí xấp xỉ 3,04. Xác định công thức phân tử của Y.
° Lời giải
– Theo bài ra, Tỉ khối hơi của Y so với không khí xấp xỉ 3,04 nên có:
MY = 29.3,04 = 88(g/mol).
– Cũng theo bài ra, đốt cháy 0,88g Y thu được 1,76 gam CO2 và 0,72 gam H2O nên có:
![]()
![]()
![]()
– Đặt công thức phân tử của Y là CxHyOz (với x, y, z nguyên dương). Thì ta có phương trình hóa học của phản ứng cháy của Y như sau:
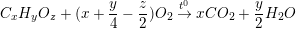
1(mol) x(mol) y/2(mol)
0,1(mol) 0,04(mol) 0,04(mol)
– Từ tỉ lệ: ![]()
Ta tính được: x = 4; y = 8;
MY = 12.4 + 1.8 + 16.z = 88 ⇒ z = 2.
– Vậy công thức phân tử của Y là C4H8O2
III. Bài tập lập công thức phân tử của hợp chất hữu cơ
* Bài 1 trang 95 SGK Hóa 11: Tính khối lượng mol phân tử của các chất sau:
a) Chất A có tỉ khối hơi so với không khí bằng 2,07.
b) Thể tích hơi của 3,3 gam chất khí X bằng thể tích của 1,76 gam khí oxi (đo cùng điều kiện về nhiệt độ, áp suất).
° Lời giải bài 1 trang 95 SGK Hóa 11:
a) Vì Mkhông khí = 29 nên ta có: dA/kk = MA/Mkk = 2,07
⇒ Khối lượng mol phân tử của A là: MA = 2,07.29 = 60(g/mol).
b) Vì cùng điều kiện nhiệt độ và áp suất nên tỉ lệ thể tích chính là tỉ lệ mol nên ta có:
![]()
– Khối lượng mol phân tử của X là: ![]()
* Bài 2 trang 95 SGK Hóa 11: Limonen là một chất có mùi thơm dịu được tách từ tinh dầu chanh. Kết quả phân tích nguyên tố cho thấy limonen được cấu tạo từ hai nguyên tố C và H, trong đó C chiếm 88,235% về khối lượng. Tỉ khối hơi của limonen so với không khí gần bằng 4,69. Lập công thức phân tử của limonen.
° Lời giải bài 2 trang 95 SGK Hóa 11:
– Gọi công thức của limonen là CxHy, ta có:
%H = 100% – %C = 100% – 88,235% = 11,765%
– Tỉ khối hơi của limonen so với không khí gần bằng 4,69 nên:
dlimonen/kk = 4,69 ⇒ Mlimonen = 4,69.29 = 136(g/mol)
– Theo bài ra, ta có:
x : y = (%C)/12 : (%H)/1 = 88,235/12 : 11,765/1 = 7,35:11,765 = 5:8
⇒ x : y ≈ 5 : 8
⇒ công thức (C5H8)n
⇒ M(C5H8)n = MC + MH = n(12.5 + 8) = 68n = 136
⇒ n = 2, vậy công thức phân tử limonen là C10H16.
* Bài 3 trang 95 SGK Hóa 11: Đốt cháy hoàn toàn 0,30 gam chất A (phân tử chỉ chứa C, H, O) thu được 0,44 gam khí cacbonic và 0,180 gam nước. Thể tích hơi của 0,30 gam chất A bằng thể tích của 0,16 gam khí oxi (ở cùng điều kiện về nhiệt độ và áp suất). Xác định công thức phân tử của chất A.
° Lời giải bài 3 trang 95 SGK Hóa 11:
– Gọi công thức hợp chất hữu cơ là CxHyOz (x,y,z nguyên dương)
– Theo bài ra, ta có:
![]()
– Thể tích hơi của 0,30 gam chất A bằng thể tích của 0,16 gam khí oxi (ở cùng điều kiện về nhiệt độ và áp suất) nên:
![]()
(lưu ý ở cùng nhiệt độ và áp suất thì tỉ lệ thể tích chính là tỉ lệ số mol)
– Mặt khác, theo bài ra thu được 0,44 gam khí cacbonic và 0,180 gam nước nên:
![]()
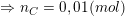
![]()
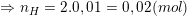
⇒ mO = mA – (mC + mH) = 0,3 – (0,01.12 + 0,02.1) = 0,16(g)
⇒ nO = 0,16/16 = 0,01(mol).
– Vậy ta có: nC : nH : nO = 0,01 : 0,02 : 0,01 = 1 : 2 : 1
⇒ công thức phân tử (CH2O)n
– Mặt khác, ta có: MA = 30n = 60 ⇒ n = 2
⇒ Công thức phân tử của A là C2H4O2.
* Bài 4 trang 95 SGK Hóa 11: Từ tinh dầu hồi, người ta tách được anetol – một chất thơm được dùng sản xuất kẹo cao su. Anetol có khối lượng mol phân tử bằng 148,0 g/mol. Phân tích nguyên tố cho thấy, anetol có %C = 81,08%; %H = 8,1%, còn lại là oxi. Lập công thức đơn giản nhất và công thức phân tử của anetol.
° Lời giải bài 4 trang 95 SGK Hóa 11:
– Gọi công thức tổng quát của anetol là CxHyOz (x,y,z nguyên dương)
– Vì anetol có %C = 81,08%; %H = 8,1% nên:
%O = 100% – (%C + %H) = 100% – (81,08 + 8,1)% = 10,82%
– Ta có tỉ lệ:
x : y : z = (%C)/12 : (%H)/1 : (%O)/16
![]()
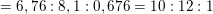
(Tối giản bằng cách chia cho số nhỏ nhất trong các giá trị trên là 0,676 để được số nguyên)
⇒ Công thức đơn giản nhất của anetol là C10H12O
– Mặt khác, Anetol có khối lượng mol phân tử bằng 148,0 g/mol nên:
M(C10H12O)n = 148 ⇒ (10.12 + 12 + 16).n = 148 ⇒ n = 1
⇒ Công thức phân tử Anetol là C10H12O.
* Bài 5 trang 95 SGK Hóa 11: Hợp chất X có phần trăm khối lượng cacbon, hiđro và oxi lần lượt bằng 54,54%, 9,1% và 36,36%. Khối lượng mol phân tử của X bằng 88 g/mol. Công thức phân tử nào sau đây ứng với hợp chất của X?
A. C4H10O B. C4H8O2 C. C5H12O D. C4H10O2.
° Lời giải bài 5 trang 95 SGK Hóa 11:
• Chọn đáp án: B. C4H8O2
– Gọi công thức tổng quát của X là CxHyOz (x,y,z nguyên dương)
– Ta có tỉ lệ: ![]()
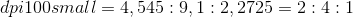
⇒ X có công thức tổng quát(công thức đơn giản nhất) là (C2H4O)n
– Mặt khá, Khối lượng mol phân tử của X bằng 88 g/mol nên ta có: M(C2H4O)n= 44n = 88 ⇒ n = 2
⇒ CTPT của hợp chất X là: C4H8O2
* Bài 6 trang 95 SGK Hóa 11: Hợp chất Z có công thức đơn giản nhất là CH3O và có tỉ khối hơi so với hiđro bằng 31,0. Công thức phân tử nào sau đây ứng với hợp chất Z?
A. CH3O B. C2H6O2 C. C2H6O D. C3H9O3
° Lời giải bài 6 trang 95 SGK Hóa 11:
• Chọn đáp án: B. C2H6O2
– Z có tỉ khối hơi so với hiđro bằng 31,0 nên: dZ/H2 = 31 ⇒ MZ = 2.31 = 62(g/mol).
– Gọi công thức phân tử của Z là (CH3O)n
⇒ MZ = 31n = 62 ⇒ n = 2;
⇒ CTPT của Z là C2H6O2.
Hy vọng với bài viết về Cách lập công thức phân tử (CTPT) hợp chất hữu cơ và Bài tập vận dụng ở trên hữu ích cho các em. Mọi thắc mắc và góp ý các em hãy để lại bình luận dưới bài viếtc, chúc các em học tốt!
Đăng bởi: thcs Hồng Thái
Chuyên mục: Giáo Dục
Xem thêm Hóa 11 bài 21
Hóa 11 bài 21: Cách lập công thức phân tử (CTPT) hợp chất hữu cơ. Hợp chất hữu cơ thường gồm có nguyên tố cacbon và các nguyên tố khác như hiđro, oxi,… vậy từ các nguyên tố này làm sao ta có thể xác định hay thiết lập được công thức phân tử của các hợp chất hữu cơ? Để giải đáp câu hỏi trên chúng ta cùng đi tìm hiểu cách xác định công thức phân tử (CTPT) đơn giản nhất của hợp chất hữu cơ. Qua đó, thiết lập công thức phân tử của hợp chất, đồng thời giải một số bài tập về lập công thức phân tử để hiểu rõ hơn nội dung lý thuyết qua bài viết dưới đây. I. Công thức đơn giản nhất 1. Định nghĩa – Công thức đơn giản nhất là công thức biểu thị tỉ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử. 2. Cách thiết lập công thức đơn giản nhất • Thiết lập công thức đơn giản nhất của hợp chất hữu cơ CxHyOz là tìm tỉ lệ: – Theo khối lượng: small x:y:z=n_{C}:n_{H}:n_{O} small =frac{m_{C}}{12}:frac{m_{H}}{1}=frac{m_{O}}{16} – Theo tỉ lệ phần trăm: theo tỉ lệ phần trăm * Ví dụ: Kết quả phân tích nguyên tố hợp chất X cho biết %C = 40,00%; %H = 6,67%, còn lại là oxi. Lập công thức đơn giản nhất của X. ° Lời giải: – Gọi công thức phân tử của X là CxHyOz (x, y, z nguyên dương). – Từ kết quả phân tích định lượng, lập được hệ thức: theo tỉ lệ phần trămsmall =frac{40,00}{12}:frac{6,67}{1}:frac{53,3}{16} small =3,33:6,67:3,33=1:2:1 ⇒ Công thức đơn giản nhất của X là CH2O. II. Công thức phân tử 1. Định nghĩa – Công thức phân tử là công thức biểu thị số lượng nguyên tử của mỗi nguyên tố trong phân tử. 2. Quan hệ giữa công thức phân tử và công thức đơn giản nhất * Ví dụ về CTPT và công thức đơn giản nhất: Hợp chất Công thức phân tử Công thức đơn giản nhất Metan CH4 CH4 Etilen C2H4 CH2 Ancol etylic C2H6O C2H6O Axit axetic C2H4O2 CH2O Glucozơ C6H12O6 CH2O – Số nguyên tử của mỗi nguyên tố trong công thức phân tử là số nguyên lần số nguyên tử của nó trong công thức đơn giản nhất. – Trong nhiều trường hợp, công thức phân tử cũng chính là công thức đơn giản nhất như: Ancol etylic C2H6O, metan CH4,… – Một số chất có công thức phân tử khác nhau nhưng có cùng một công thức đơn giản nhất như: Axetilen C2H2 và benzen C6H6; axit axetic C2H4O2 và glucozơ C6H12O6,… 3. Cách thiết lập công thức phân tử hợp chất hữu cơ a) Lập công thức phân tử (CTPT) dựa vào thành phần phần trăm khối lượng các nguyên tố Xét sơ đồ: CxHyOz → xC + yH + zO Khối lượng: M (g) 12.x 1.y 16.z (g) Thành phần phần trăm khối lượng: 100% %C % H % O Từ tỉ lệ thức: lập ctpt hợp chất hữu cơ Suy ra: lập công thức phân tử cho hợp chất hữu cơ * Ví dụ: Phenolphtalein – chất chỉ thị màu dùng nhận biết dung dịch bazơ – có phần trăm khối lượng C, H và O lần lượt bằng 75,47%, 4,35% và 20,18%. Khối lượng mol phân tử của phenolphtalein bằng 318,0 g/mol. Hãy lập công thức phân tử của phenolphtalein. ° Lời giải – Ta thấy %C + %H + %O = 100% ⇒ Thành phần phân tử phenolphtalein gồm ba nguyên tố C, H, O nên ta đặt công thức phân tử là CxHyOz (với x, y, z nguyên dương). – Theo bài ra, ta có: small x=frac{318.85,47}{12.100}=20 small y=frac{318.4,35}{1.100}=14 small z=frac{318.20,18}{16.100}=4 ⇒ Công thức phân tử của phenolphtalein là C20H14O4. b) Lập công thức phân tử (CTPT) thông qua công thức đơn giản nhất * Ví dụ: Chất hữu cơ X có công thức đơn giản nhất CH2O và có khối lượng mol phân tử bằng 60,0 g/mol. Xác định công thức phân tử của X. ° Lời giải – Công thức phân tử của X là (CH2O)n hay CnH2nOn. – Theo bài ra: MX = (12 + 2.1 + 16).n = 60 ⇔ 30n = 60 ⇒ n = 2. – Vậy X có công thức phân tử C2H4O2. c) Lập công thức phân tử (CTPT) bằng cách tính trực tiếp theo khối lượng sản phẩm đốt cháy * Ví dụ: Hợp chất Y chứa các nguyên tố C, H, O. Đốt cháy hoàn toàn 0,88 gam Y thu được 1,76 gam CO2 và 0,72 gam H2O. Tỉ khối hơi của Y so với không khí xấp xỉ 3,04. Xác định công thức phân tử của Y. ° Lời giải – Theo bài ra, Tỉ khối hơi của Y so với không khí xấp xỉ 3,04 nên có: MY = 29.3,04 = 88(g/mol). – Cũng theo bài ra, đốt cháy 0,88g Y thu được 1,76 gam CO2 và 0,72 gam H2O nên có: small n_{Y}=frac{0,88}{88}=0,01(mol) small n_{CO_{2}}=frac{1,76}{44}=0,04(mol) small n_{H_{2}O}=frac{0,72}{18}=0,04(mol) – Đặt công thức phân tử của Y là CxHyOz (với x, y, z nguyên dương). Thì ta có phương trình hóa học của phản ứng cháy của Y như sau: small C_{x}H_{y}O_{z}+(x+frac{y}{4}-frac{z}{2})O_{2} overset{t^{0}}{ ightarrow}xCO_{2}+frac{y}{2}H_{2}O 1(mol) x(mol) y/2(mol) 0,1(mol) 0,04(mol) 0,04(mol) – Từ tỉ lệ: small frac{1}{0,01}=frac{x}{0,04}=frac{y}{2.0,04} Ta tính được: x = 4; y = 8; MY = 12.4 + 1.8 + 16.z = 88 ⇒ z = 2. – Vậy công thức phân tử của Y là C4H8O2 III. Bài tập lập công thức phân tử của hợp chất hữu cơ * Bài 1 trang 95 SGK Hóa 11: Tính khối lượng mol phân tử của các chất sau: a) Chất A có tỉ khối hơi so với không khí bằng 2,07. b) Thể tích hơi của 3,3 gam chất khí X bằng thể tích của 1,76 gam khí oxi (đo cùng điều kiện về nhiệt độ, áp suất). ° Lời giải bài 1 trang 95 SGK Hóa 11: a) Vì Mkhông khí = 29 nên ta có: dA/kk = MA/Mkk = 2,07 ⇒ Khối lượng mol phân tử của A là: MA = 2,07.29 = 60(g/mol). b) Vì cùng điều kiện nhiệt độ và áp suất nên tỉ lệ thể tích chính là tỉ lệ mol nên ta có: small n_{X}= n_{O_{2}}=frac{1,76}{32}=0,055(mol) – Khối lượng mol phân tử của X là: small M_{X}=frac{3,3}{0,055}=60(g/mol) * Bài 2 trang 95 SGK Hóa 11: Limonen là một chất có mùi thơm dịu được tách từ tinh dầu chanh. Kết quả phân tích nguyên tố cho thấy limonen được cấu tạo từ hai nguyên tố C và H, trong đó C chiếm 88,235% về khối lượng. Tỉ khối hơi của limonen so với không khí gần bằng 4,69. Lập công thức phân tử của limonen. ° Lời giải bài 2 trang 95 SGK Hóa 11: – Gọi công thức của limonen là CxHy, ta có: %H = 100% – %C = 100% – 88,235% = 11,765% – Tỉ khối hơi của limonen so với không khí gần bằng 4,69 nên: dlimonen/kk = 4,69 ⇒ Mlimonen = 4,69.29 = 136(g/mol) – Theo bài ra, ta có: x : y = (%C)/12 : (%H)/1 = 88,235/12 : 11,765/1 = 7,35:11,765 = 5:8 ⇒ x : y ≈ 5 : 8 ⇒ công thức (C5H8)n ⇒ M(C5H8)n = MC + MH = n(12.5 + 8) = 68n = 136 ⇒ n = 2, vậy công thức phân tử limonen là C10H16. * Bài 3 trang 95 SGK Hóa 11: Đốt cháy hoàn toàn 0,30 gam chất A (phân tử chỉ chứa C, H, O) thu được 0,44 gam khí cacbonic và 0,180 gam nước. Thể tích hơi của 0,30 gam chất A bằng thể tích của 0,16 gam khí oxi (ở cùng điều kiện về nhiệt độ và áp suất). Xác định công thức phân tử của chất A. ° Lời giải bài 3 trang 95 SGK Hóa 11: – Gọi công thức hợp chất hữu cơ là CxHyOz (x,y,z nguyên dương) – Theo bài ra, ta có: small n_{O_{2}}=frac{0,16}{32}=0,005(mol) – Thể tích hơi của 0,30 gam chất A bằng thể tích của 0,16 gam khí oxi (ở cùng điều kiện về nhiệt độ và áp suất) nên: small M_{A}=frac{0,3}{0,005}=60(g/mol) (lưu ý ở cùng nhiệt độ và áp suất thì tỉ lệ thể tích chính là tỉ lệ số mol) – Mặt khác, theo bài ra thu được 0,44 gam khí cacbonic và 0,180 gam nước nên: small n_{CO_{2}}=frac{0,44}{44}=0,01(mol)small Rightarrow n_{C}=0,01(mol) small n_{H_{2}O}=frac{0,18}{18}=0,01(mol) small Rightarrow n_{H}=2.0,01=0,02(mol) ⇒ mO = mA – (mC + mH) = 0,3 – (0,01.12 + 0,02.1) = 0,16(g) ⇒ nO = 0,16/16 = 0,01(mol). – Vậy ta có: nC : nH : nO = 0,01 : 0,02 : 0,01 = 1 : 2 : 1 ⇒ công thức phân tử (CH2O)n – Mặt khác, ta có: MA = 30n = 60 ⇒ n = 2 ⇒ Công thức phân tử của A là C2H4O2. * Bài 4 trang 95 SGK Hóa 11: Từ tinh dầu hồi, người ta tách được anetol – một chất thơm được dùng sản xuất kẹo cao su. Anetol có khối lượng mol phân tử bằng 148,0 g/mol. Phân tích nguyên tố cho thấy, anetol có %C = 81,08%; %H = 8,1%, còn lại là oxi. Lập công thức đơn giản nhất và công thức phân tử của anetol. ° Lời giải bài 4 trang 95 SGK Hóa 11: – Gọi công thức tổng quát của anetol là CxHyOz (x,y,z nguyên dương) – Vì anetol có %C = 81,08%; %H = 8,1% nên: %O = 100% – (%C + %H) = 100% – (81,08 + 8,1)% = 10,82% – Ta có tỉ lệ: x : y : z = (%C)/12 : (%H)/1 : (%O)/16 small =frac{81,08}{12}:frac{8,1}{1}:frac{10,82}{16} small =6,76:8,1:0,676 =10:12:1 (Tối giản bằng cách chia cho số nhỏ nhất trong các giá trị trên là 0,676 để được số nguyên) ⇒ Công thức đơn giản nhất của anetol là C10H12O – Mặt khác, Anetol có khối lượng mol phân tử bằng 148,0 g/mol nên: M(C10H12O)n = 148 ⇒ (10.12 + 12 + 16).n = 148 ⇒ n = 1 ⇒ Công thức phân tử Anetol là C10H12O. * Bài 5 trang 95 SGK Hóa 11: Hợp chất X có phần trăm khối lượng cacbon, hiđro và oxi lần lượt bằng 54,54%, 9,1% và 36,36%. Khối lượng mol phân tử của X bằng 88 g/mol. Công thức phân tử nào sau đây ứng với hợp chất của X? A. C4H10O B. C4H8O2 C. C5H12O D. C4H10O2. ° Lời giải bài 5 trang 95 SGK Hóa 11: • Chọn đáp án: B. C4H8O2 – Gọi công thức tổng quát của X là CxHyOz (x,y,z nguyên dương) – Ta có tỉ lệ: small x:y:z=frac{54,54}{12}:frac{9,1}{1}:frac{36,36}{16} small =4,545:9,1:2,2725=2:4:1 ⇒ X có công thức tổng quát(công thức đơn giản nhất) là (C2H4O)n – Mặt khá, Khối lượng mol phân tử của X bằng 88 g/mol nên ta có: M(C2H4O)n= 44n = 88 ⇒ n = 2 ⇒ CTPT của hợp chất X là: C4H8O2 * Bài 6 trang 95 SGK Hóa 11: Hợp chất Z có công thức đơn giản nhất là CH3O và có tỉ khối hơi so với hiđro bằng 31,0. Công thức phân tử nào sau đây ứng với hợp chất Z? A. CH3O B. C2H6O2 C. C2H6O D. C3H9O3 ° Lời giải bài 6 trang 95 SGK Hóa 11: • Chọn đáp án: B. C2H6O2 – Z có tỉ khối hơi so với hiđro bằng 31,0 nên: dZ/H2 = 31 ⇒ MZ = 2.31 = 62(g/mol). – Gọi công thức phân tử của Z là (CH3O)n ⇒ MZ = 31n = 62 ⇒ n = 2; ⇒ CTPT của Z là C2H6O2. Hy vọng với bài viết về Cách lập công thức phân tử (CTPT) hợp chất hữu cơ và Bài tập vận dụng ở trên hữu ích cho các em. Mọi thắc mắc và góp ý các em hãy để lại bình luận dưới bài viếtc, chúc các em học tốt! Đăng bởi: thcs Hồng Thái Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường THCS Hồng Thái Hải Phòng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường thcs Hồng Thái (thcshongthaiad.edu.vn)
Nguồn: https://thcshongthaiad.edu.vn
Danh mục: Tra Cứu
