Bài tập về Oxi (O2), Ozon (O3) cơ bản, nâng cao có đáp án và lời giải – hoá lớp 10

Như đã biết bài tập về oxi O2 và ozon O3 cũng rất hay xuất hiện trong nội dung đề thi THPT quốc gia, và chúng cũng có một số dạng bài tập khiến ta phải ‘đau đầu’ khi giải các dạng toán này.
Bạn đang xem: Bài tập về Oxi (O2), Ozon (O3) cơ bản, nâng cao có đáp án và lời giải – hoá lớp 10
Vì vậy, nhằm hệ thống lại một số dạng bài tập về Oxi O2 , Ozon O3 cùng phương pháp giải nhanh gọn, chính xác, cụ thể và chi tiết qua các ví dụ dưới đây hy vọng sẽ giúp các bạn cảm thấy ‘dễ thở’ hơn khi gặp các dạng toán này.
I. Một số nội dung lý thuyết vận dụng để giải bài tập
Bạn đang xem: Bài tập về Oxi (O2), Ozon (O3) cơ bản, nâng cao có đáp án và lời giải – hoá lớp 10
1. Định luật bảo toàn khối lượng
• mchất = ∑mcác thành phần = ∑mcác nguyên tố
– Ví dụ: mH2SO4 = mH + mO + mS
• ∑mtrước phản ứng = ∑msau phản ứng
– Ví dụ: Al + O2 → Al2O3
⇒ mAl + mO2 = mAl2O3
2. Định luật bảo toàn Electron
• Tổng số electron cho = Tổng số electron nhận: ∑e cho = ∑e nhận
• Tổng số mol e cho = Tổng số mol e nhận: ∑e cho = ∑e nhận
⇒ (số e cho).(số mol chất cho) = (số e nhận).(số mol chất nhận)
– Ví dụ: Al + O2 → Al2O3
⇒ Bảo toàn e: 3.nAl = 4.nO2
3. Định luật bảo toàn Nguyên tố
• Trong phản ứng hoá học, các nguyên tố luôn được bảo toàn (không đổi).
⇒ Khối lượng nguyên tố không đổi
⇒ Số mol nguyên tố không đổi
⇒ ∑[(số nguyên tử).(số mol)]trước = ∑[(số nguyên tử).(số mol)]sau
– Ví dụ: FeO + O2 → Fe3O4
⇒ Bảo toàn O: 1.mFe + 2.nO2 = 4nFe3O4
– Lưu ý: Các bài tập có nhiều phản ứng oxi hoá khử, chúng ta không nên giải theo phương pháp truyền thống mà nên ưu tiên áp dụng các định luật bảo toàn trên để giải các dạng bài tập này.
– Nếu chưa nắm vững tính chất hoá học của Oxi, Ozon hay Lưu huỳnh S các em có thể tham khảo lại nội dung này ở các bài viết:
• xem thêm: Tính chất hoá học của Oxi và Ozon
II. Một số dạng bài tập về Oxi, Ozon và Lưu huỳnh
Bài tập 1: Oxi hoá hoàn toàn m gam hỗn hợp X gồm Cu và Al có tỉ lệ mol 1:1 thu được 13,1 gam hỗn hợp Y gồm các oxit. Tính giá trị của m?
* Lời giải:
Xem thêm : Phương pháp luận là gì? Ý nghĩa của phương pháp luận với thực tế cuộc sống
• Cách 1: Giải bài toán dựa theo PTPƯ
– Gọi a là số mol của kim loại Cu và Al trong hỗn hợp X
– Phương trình hoá học của phản ứng:
2Cu + O2 → 2CuO
a mol a mol
4Al + 3O2 → 2Al2O3
a mol a/2 mol
– Ta có: mY (oxit) = mCuO + mAl2O3 = 80.a +102.(a/2) = 13,1 ⇒ a = 0,1(mol).
⇒ mX = 64.0,1 + 27.0,1 = 9,1(g).
• Cách 2: Giải bài toán dựa vào các định luật bảo toàn
– Gọi a là số mol của mỗi kim loại Cu, Al trong hỗn hợp X
– Theo định luật bảo toàn nguyên tố Cu, Al ta có:
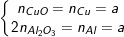
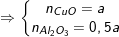
– Theo định luật bảo toàn khối lượng thì:
mY = mCuO + mAl2O3 = 80.a +51.a = 13,1 ⇒ a = 0,1(mol).
⇒ mX = 64.0,1 + 27.0,1 = 9,1(g).
Bài tập 2: Nung một hỗn hợp gồm 4,8 gam bột Magie và 3,2 gam bột lưu huỳnh trong một ống nghiệm đậy kín. Tính khối lượng chất rắn thu được sau phản ứng?
* Lời giải:
Xem thêm : Phương pháp luận là gì? Ý nghĩa của phương pháp luận với thực tế cuộc sống
• Cách 1: Giải bài toán dựa theo PTPƯ
– Theo bài ra, ta có: nMg = 4,8/24 = 0,2(mol). nS = 3,2/32 = 0,1(mol).
– PTPƯ: Mg + S → MgS
Ban đầu: 0,1 0,1 mol
Phản ứng: 0,1 0,1
Sau PƯ: 0,1 0,1 mol
– Ta thấy: 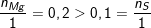 nên Mg dư
nên Mg dư
⇒ Hỗn hợp chất rắn gồm: MgS và Mg dư
⇒ mrắn = 56.0,1 + 24.0,1 = 8(g).
• Cách 2: Giải bài toán theo các định luật bảo toàn
– Nếu Mg dư, S dư hay cả hai cùng dư thì tất cả các chất sau phản ứng đều là chất rắn. Về nguyên tắc của định luật bảo toàn khối lượng thì tổng khối lượng của nó sẽ bằng tổng khối lượng các chất trước phản ứng, mặc dù ta không cần biết sau phản ứng chứa những chất nào và với lượng là bao nhiêu.
– ĐLBTKL: mrắn = mMg + mS = 4,8 + 3,2 = 8(g).
Bài tập 3: Đốt cháy hoàn toàn 13 gam một kim loại hóa trị II trong oxi dư đến khối lượng không đổi thu được 16,2 gam chất rắn X. Kim loại đó là gì?
* Lời giải:
Xem thêm : Phương pháp luận là gì? Ý nghĩa của phương pháp luận với thực tế cuộc sống
• Cách 1: Giải bài toán dựa theo PTPƯ
– Gọi kim loại cần tìm là M.
– Phương trình phản ứng: 2M + O2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_04/1554292296bm1m8aig25.gif) 2MO
2MO
– Theo PTPƯ, ta có: nM = nMO ![]()
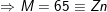
• Cách 2: Giải bài toán theo các định luật bảo toàn
– Chúng ta không cần viết phương trình phản ứng, mà chỉ áp dụng các định luật bảo toàn.
– Bảo toàn khối lượng ⇒ mO2 = mrắn X – mM
⇒ 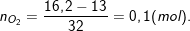
– Theo ĐLBT e: 2nM = 4nO2 ⇒ nM = 2nO2 = 2.0,1 = 0,2(mol).
⇒ ![]()
Bài tập 4: Cho 7,2 gam kim loại M , có hoá trị không đổi trong hợp chất, phản ứng hoàn toàn với hỗn hợp khí X gồm Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn Y và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (ở đktc). Xác định kim loại M?
* Lời giải:
– Sơ đồ bài toán: 7,2 gam M + 5,6 lít khí X (Cl2, O2) ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_04/1554303434341scv1948.gif) 23 gam chất rắn Y (MClx, M2Ox)
23 gam chất rắn Y (MClx, M2Ox)
Xem thêm : Phương pháp luận là gì? Ý nghĩa của phương pháp luận với thực tế cuộc sống
• Cách 1: Giải bài toán dựa theo PTPƯ
– Gọi x là hóa trị của kim loại M; a, b lần lượt là số mol Cl2 và O2 trong hỗn hợp X
2M + xCl2 → 2MClx
2a/x ← a mol → 2a/x
4M + xO2 → 2M2Ox
4b/x ← b mol → 2b/x
– Theo bài ra, và từ PTPƯ ta có:
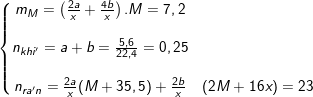
– Giải hệ được: M = 12.x ⇒ chọn x = 2 ⇒ M = 24 ≡ Mg
• Cách 2: Giải bài toán theo các định luật bảo toàn
– Ta có: nX = nCl2 + nO2 = 5,6/22,4 = 0,25(mol).
– Theo ĐLBTKL ta có: mX = mY – mM = 23 – 7,2 = 71.nCl2 + 32.nO2
⇒ nCl2 = 0,2(mol) và nO2 = 0,05(mol).
= Gọi a là hóa trị của kim loại ta, theo định luật bảo toàn e, ta có: a.nM = 2.nCl2 + 4.nO2
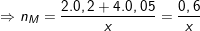
![]()
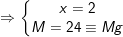
* Nhận xét về 2 cách giải trên:
– Cách 1: Khi giải phương pháp truyền thống dựa vào phương trình phản ứng sau đó lập hệ phương trình sẽ khó khăn khi phải biện luận.
– Cách 2: Chỉ áp dụng các định luật bảo toàn không cần viết phương trình phản ứng, tuy lúc đầu 1 số bạn chưa quen nhưng khi đã hiểu và vận dụng các bạn sẽ thấy đây là phương pháp rất hiệu quả và nên dùng phương pháp này đặc biệt là bây giờ các em chuyển qua thi trắc nghiệm hoá.
Bài tập 5: Hỗn hợp khí X gồm ozon và oxi có tỉ khối đối với hiđro bằng 18. Phần trăm theo thể tích mỗi khí trong hỗn hợp X lần lượt là bao nhiêu?
* Lời giải:
– Sơ đồ bài toán: VO3 lít O3 (M=48) và VO2 lít O2 (M=32) → 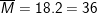 → Khối lượng tăng giảm là (36-32) và (48-36)
→ Khối lượng tăng giảm là (36-32) và (48-36)
Xem thêm : Giải SBT bài 28: Trao đổi khí ở sinh vật
– Tỉ khối của hỗn hợp X so với H2 là 18 nên ta có: 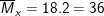
⇒ ![]()
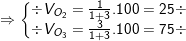
– Vậy phần trăm thể tích của O2 là 25% O3 là 75%.
Bài tập 6: Hỗn hợp X gồm SO2 và O2 có tỉ khối hơi đối với H2 bằng 24. Cần thêm V lít O2 vào 20 lít hỗn hợp X để thu được hỗn hợp Y có tỉ khối hơi so với H2 bằng 22,4. Biết thể tích các khí đo trong cùng điều kiện nhiệt độ và áp suất tìm V?
* Lời giải:
– Tỉ khối của X so với H2 là 24, nên ta có khối lượng trung bình của hỗn hợp X là: 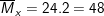
– Sơ đồ bài toán: VO2 lít O2 (M=32) và 20 lít X (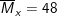 ) →
) → 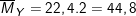 → Khối lượng tăng giảm là (48-44,8) và (44,8-32)
→ Khối lượng tăng giảm là (48-44,8) và (44,8-32)
⇒ ![]()
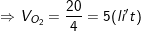
Bài tập 7: Cho V lít hỗn hợp khí X gồm O2 và O3. Thực hiện phản ứng ozon phân hoàn toàn, sau một thời gian thu được khí Y và thể tích khí tăng lên 30% so với thể tích ban đầu , biết thể tích các khí đo ở cùng điều kiện nhiệt độ và áp suất. Tính phần trăm thể tích của O2 trong hỗn hợp đầu.
* Lời giải:
– Sơ đồ bài toán: V lít hỗn hợp X (O2 và O3) → Y (O2) có ΔV=30%
– Phương trình phản ứng:
2O3 – ozon phân→ 3O2
a lít 1,5a lít
– Ta chọn hỗn hơn X ban đầu có thể tích VX = 100 lít (không làm mất tính tổng quát bài toán). ⇒ VY = 130(lít).
⇒ VY = 1,5a + (100-a) = 130 ⇒ a = 60 ⇒ VO2 = 100 – 60 = 40(lít) ⇔ %VO2 = 40%
Bài tập 8: Phóng điện qua O2 được hỗn hợp khí có khối lượng mol trung bình là 33 g/mol. Tính hiệu suất của phản ứng ozon hóa?
* Lời giải:
– Sơ đồ bài toán: V lít (O2) – tia lửa điện→ V lít hỗn hợp có 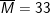 gồm (O3 và O2 dư)
gồm (O3 và O2 dư)
– Phương trình phản ứng
3O2 -tia lửa điện→ 2O3
– Sơ đồ bài toán: VO3 lít O3 (M=48) và VO2 lít O2 dư (M=32) → 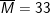 → Khối lượng tăng giảm là (33-32) và (48-33)
→ Khối lượng tăng giảm là (33-32) và (48-33)
⇒ ![]()
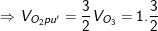
![]()
![]() %
%
Bài tập 9: Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 bằng 20. Để đốt cháy hoàn toàn 4,48 lít khí CH4 cần V lít hỗn hợp khí X. Các khí đo ở điều kiện tiêu chuẩn. Tính giá trị của V?
* Lời giải:
– Sơ đồ bài toán: X gồm (O2 và O3) + 0,2 mol metan CH4 → CO2 + H2O
– Sơ đồ đường chéo: 
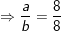
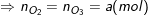
* Cách 1: giải theo cách thông thường truyền thống
– Ta có phương trình phản ứng:
CH4 + 2O2 → CO2↑ + 2H2O
a/2 a(mol)
CH4 + 4/3O3 → CO2↑ + 2H2O
(3/4)a a(mol)
– Theo PTPƯ, ta có: 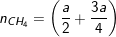
![]()
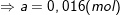
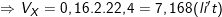
* Cách 2: Sử dụng định luật bảo toàn
– ĐLBT nguyên tố C và H ta có:
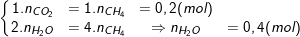
– ĐLBT nguyên tố O: 2.nO2 + 3.nO3 = 2.nCO2 + 1.nH2O
⇒ 2a + 3a = 2.0,2 + 0,4 ⇒ a = 0,16(mol).
⇒ VX = 0,16.2.22,4 = 7,168 (lít).
Hy vọng với bài viết hệ thống một số dạng bài tập về Oxi, Ozon và Lưu huỳnh cùng bài tập và ví dụ ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
Đăng bởi: thcs Hồng Thái
Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường THCS Hồng Thái Hải Phòng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường thcs Hồng Thái (thcshongthaiad.edu.vn)
Nguồn: https://thcshongthaiad.edu.vn
Danh mục: Tra Cứu

