Tính chất hóa học của Flo (F) Brom (Br) iot, bài tập về Flo Brom Iot – hóa 10 bài 25
Flo, brom và iot cũng là các halogen có tính oxi hóa mạnh và thực tế cho thấy chúng dễ dàng liên kết ion với các kim loại và oxi hóa các kim loại đến hóa trị cao nhất.
Bạn đang xem: Tính chất hóa học của Flo (F) Brom (Br) iot, bài tập về Flo Brom Iot – hóa 10 bài 25
Các nguyên tố Flo, brom, iot cùng thuộc nhóm VIIA chung với Clo vậy chúng có những tính chất nào giống và khác với clo, có những ứng dụng gì và điều chế chúng thế nào, chúng ta hãy cùng tìm hiểu qua bài viết này.
I. Tính chất của Flo (F)
Bạn đang xem: Tính chất hóa học của Flo (F) Brom (Br) iot, bài tập về Flo Brom Iot – hóa 10 bài 25
1. Tính chất vật lý của Flo
– Là chất khí, màu lục nhạt, độc.
2. Tính chất hóa học của Flo
– Flo là phi kim mạnh nhất (có độ âm điện lớn nhất) nên Flo có tính oxi hóa mạnh nhất.
a) Flo tác dụng với kim loại
– Flo oxi hóa được tất cả các kim loại tạo thành muối florua:
* PTPƯ: 2M + nF2 → 2MFn
* Ví dụ: 2Na + F2 → 2NaF
2Fe + 3F2 → 2FeF3
Zn + F2 → ZnF2
b) Flo tác dụng với phi kim
– Khí flo oxi hóa được hầu hết các phi kim (trừ oxi và nito).
* Ví dụ: 3F2 + S → SF6
c) Flo tác dụng với hiđro H2
– Phản ứng xảy ra ngay cả trong bóng tối (gây nổ mạnh) tạo thành hiđro florua
F2 + H2 → 2HF↑
– Khí HF tan vô hạn trong nước tạo ra dd axit flohidric, khác với axit HCl, axit HF là axit yếu, tính chất đặc biệt của axit HF là tác dụng với silic đioxit (SiO2) có trong thành phần thủy tinh) ⇒ do đó không dùng chai lọ thủy tinh để đựng dd axit HF.
SiO2 + 4HF → SiF4 + 2H2O
d) Flo tác dụng với nước H2O
– Khí flo oxi hóa nước dễ dàng ngay cả ở nhiệt độ thường,Hơi nước bốc cháy khi tiếp xúc với khí flo:
2F2 + 2H2O → 4HF + O2
II. Tính chất của Brom Br2
1. Tính chất vật lý của Brom Br2
– Brom là chất lỏng màu đỏ nâu, mùi khó chịu, dễ bay hơi, độc.
2. Tính chất hóa học của Brom
– Brom cũng là nguyên tố oxi hóa mạnh nhưng yếu hơn Flo và Clo.
a) Brom tác dụng với kim loại
Xem thêm : Phương pháp luận là gì? Ý nghĩa của phương pháp luận với thực tế cuộc sống
– Brom oxi hóa được nhiều kim loại (phản ứng cần đun nóng).
* Ví dụ: 3Br2 + 2Al ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/giflatexsmallspacexrightarrowt_1548677814.gif) 2AlBr3
2AlBr3
b) Brom tác dụng với hidro H2
– Brom Br2 oxi hóa được hidro H2 ở nhiệt độ cao (không gây nổ) tạo thành hidro bromua.
Br2 + H2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/giflatexsmallspacexrightarrowt_1548677814.gif) 2HBr
2HBr
– Khí HBr tan trong nước tạo thành dd axit bromhidric, đây là axit mạnh, mạnh hơn axit HCl.
c) Brom tác dụng với nước H2O
– Khi tan trong nước, 1 phần brom tác dụng rất chậm với nước tạo ra axit HBr và axit HBrO (axit hipobromơ), là phản ứng thuận nghịch.
Br2 + H2O  HBr + HBrO
HBr + HBrO
III. Tính chất của Iot I2
1. Tính chất vật lý của iot I2
– iot là chất rắn, dạng tinh thể, màu đen tím, khi đun nóng iot rắn biến thành hơi không qua trạng thái lỏng (gọi là hiện tượng thăng hoa).
2. Tính chất hóa học của iot I2
a) iot tác dụng với kim loại
– Iot oxi hóa được nhiều kim loại nhưng chỉ xảy ra khi đun nóng hoặc có xúc tác.
3I2 + 2Al ![small xrightarrow[]{t^{0},xt}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/giflatexsmallspacexrightarrowt0_1548683292.gif) 2AlI3
2AlI3
b) iot tác dụng với hidro H2
– Phản ứng xảy ra ở nhiệt độ cao, có xúc tác, phản ứng thuận nghịch (tạo thành khí hidro iotua):
I2 + H2 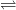 2HI
2HI
– Hidro iotua dễ tan trong nước tạo thành dd axit Iothidric, đó là 1 axit rất mạnh, mạnh hơn cả axit clohidric HCl , bromhidric HBr.
* Iot hầu như KHÔNG tác dụng với H2O
c) Iot có tính oxi hóa kém clo và brom (nên bị clo và brom đẩy ra khỏi muối):
Cl2 + 2NaI → 2NaCl + I2
Br2 + 2NaI → 2NaBr + I2
d) Iot có tính chất đặc trưng là tác dụng với hồ (tinh bột) tạo thành hợp chất có màu xanh.
* Bảng tóm tắt tính chất hóa học của Flo, Brom, Iot, Clo

* Phương pháp điều chế Flo, Brom, Iot và Clo

IV – Phân Biệt Các Ion F–, Cl–, Br–, I–
|
|
NaF |
NaCl |
NaBr |
NaI |
|
AgNO3 |
Không PƯ |
AgCl↓ trắng |
AgBr↓ vàng nhạt |
AgI↓ vàng |
V. Bài tập Flo, Brom, iot
Bài 1 trang 113 sgk hóa 10: Dung dịch axit nào sau đây không thể chứa trong bình thủy tinh:
A. HCl. B. H2SO4. C. HNO3. D. HF.
Lời giải bài 1 trang 113 sgk hóa 10:
* Đáp án: D đúng.
– Vì có PTPƯ: SiO2 + 4HF → SiF4 + 2H2O
– Do đó HF không thể chứa trong bình thủy tinh (HF được dùng để khắc chữ lên thủy tinh)
Bài 2 trang 113 sgk hóa 10: Đổ dung dịch chứa 1g HBr vào dung dịch chứa 1g NaOH. Nhúng giấy quỳ tím vào dung dịch thu được thì giấy quỳ tím chuyển sang nàu nào sau đây:
A. Màu đỏ. B. Màu xanh. C. Không đổi màu. D. Không xác được.
Lời giải bài 2 trang 113 sgk hóa 10:
* Đáp an: B đúng.
– Theo bài ra, ta có: nHBr = 1/81 mol; nNaOH = 1/40 mol
– PTPƯ: NaOH + HBr → NaBr + H2O
– Theo PTPƯ tỉ lệ nNaOH : nHBr = 1 : 1
– Theo bài ra thì: nNaOH > nHBr (1/40 > 1/81) ⇒ sau phản ứng NaOH dư
⇒ nhúng giấy quỳ vào dung dịchthì giấy quỳ sẽ chuyển màu xanh.
Bài 5 trang 113 sgk hóa 10: Muối NaCl có lẫn tạp chất là NaI.
a) Làm thế nào để chứng minh rằng trong muối NaCl nói trên có lẫn tạp chất NaI?.
Hy vọng với bài viết hệ thống lại kiến thức về tính chất hóa học của Flo, Brom, Iot và bài tập vận dụng ở trên hữu ích với các em. Mọi thắc mắc và góp ý các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, nhớ chia sẻ nếu bài viết hay, chúc các em học tập tốt.
Đăng bởi: thcs Hồng Thái
Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường THCS Hồng Thái Hải Phòng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường thcs Hồng Thái (thcshongthaiad.edu.vn)
Nguồn: https://thcshongthaiad.edu.vn
Danh mục: Tra Cứu