Kali Clorat KClO3 là gì? KClO3 điều chế thế nào, mua ở đâu?
Được xem là loại clorat có nhiều ứng dụng nhất hiện nay, kali clorat KClO3 ngày càng trở thành một hóa chất quan trọng trong cuộc sống và sản xuất. Vậy kali clorat KClO3 là gì? Những đặc điểm nào dẫn đến ứng dụng phổ biến của nó? Vai trò cụ thể của hóa chất này là gì? Cùng đón đọc bài viết sau của VietChem để giải đáp các vấn đề này.
- Sơ đồ tư duy Đoàn thuyền đánh cá
- https://thcshongthaiad.edu.vn/vat-ly-7-bai-13-moi-truong-truyen-am-la-gi-su-truyen-am-trong-chat-ran-chat-long-chat-khi-va-van-toc-truyen-am/
- Nguồn lực và động lực cho thúc đẩy phục hồi và phát triển kinh tế – xã hội trong điều kiện thích ứng an toàn – Nhìn từ thực tiễn tỉnh Quảng Ninh – Media story – Tạp chí Cộng sản
- 100 câu hỏi trắc nghiệm Lịch sử Việt Nam từ 1945 đến 1954 (Có đáp án)
- Mô tả các bước trong quá trình dinh dưỡng ở động vật. | SBT Khoa học tự nhiên 7 cánh diều
Sơ lược về kali clorat KClO3
1. Kali Clorat KClO3 là gì?
Kali Clorat có công thức hóa học KClO3, là một hợp chất hóa học chứa oxy của clo hay hiểu đơn giản nó là muối của axit cloric.
Bạn đang xem: Kali Clorat KClO3 là gì? KClO3 điều chế thế nào, mua ở đâu?
Một số tên gọi khác: Potassium chlorate, kali chlorate, chlorate kali hay potcrate,…
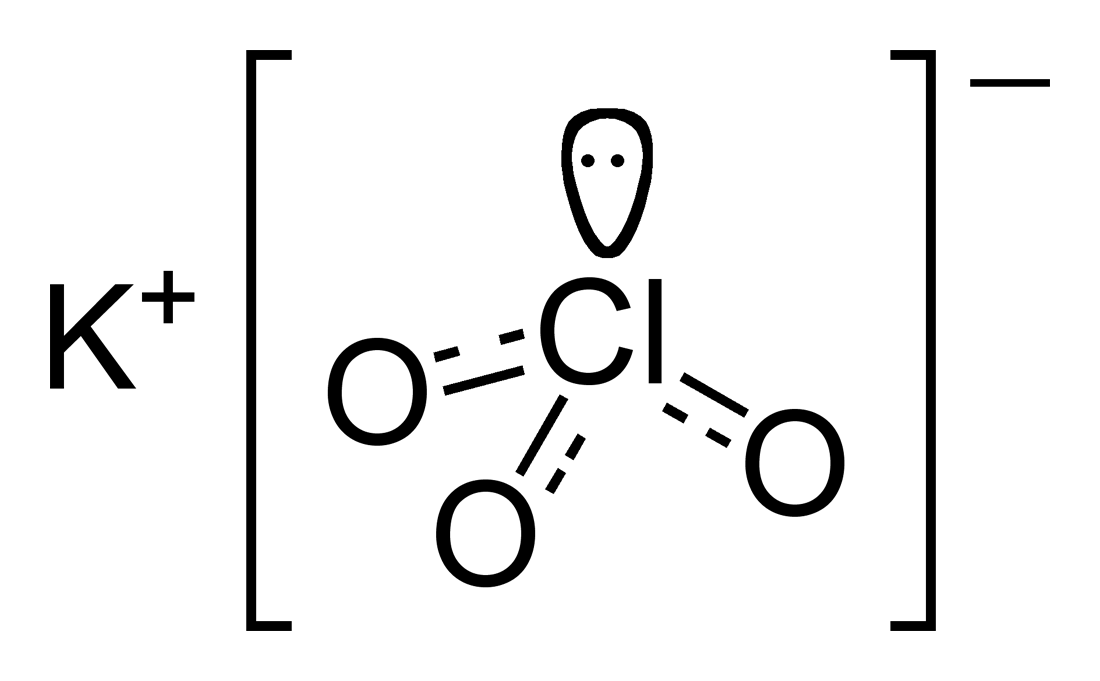
2. Cấu tạo phân tử của KClO3

Công thức phân tử của Kali clorat KClO3
3. Tính chất vật lý của kali clorat
- Ở dạng tinh thể có màu trắng hoặc không màu
- Tan nhiều trong nước nóng nhưng ít tan trong nước lạnh và không tan trong cồn tuyệt đối
- Khối lượng mol: 122,5492 g/mol
- Khổi lượng riêng: 2.32 g/cm3
- Điểm nóng chảy: 356 oC (629 K, 673 oF)
- Điểm sôi: 400 oC (673 K, 752 oF)
- Độ hòa tan trong nước: 3.13 g/100ml (ở 0 oC), 8.15 g/100ml (ở 25 oC), 53.51 g/100ml (ở 100 oC), 2930 g/100ml (330 oC)
- Độ hòa tan trong Glycerol: 1 g/100 g (20 ℃)
- Cấu trúc tinh thể: Đơn nghiêng
- Entanpi hình thành ΔfHo298: -391,2 kJ/mol
- Entropy mol tiêu chuẩn So298: 142,97 J/mol·K
- Nhiệt dung: 100,25 J/mol·K
- Chỉ dẫn R: R9 (Nổ khi tạo hỗn hợp với vật liệu dễ bắt lửa), R20/22 (Nguy hiểm khi hít/ nuốt vào.), R51/53 (Độc với thủy sinh vật và môi trường)
- Chỉ dẫn S: S2 (Tránh xa tầm tay trẻ em), S13 (Tránh xa thực phẩm, đồ uống và thực ăn cho động vật), S16 (Để xa nguồn đánh lửa – Không hút thuốc) , S27 (Cởi ngay lập tức tất cả các quần áo bị ô nhiễm), S61 (Tránh đưa chất này vào môi trường. Hãy tham khảo các hướng dẫn an toàn)
4. Tính chất hóa học của kali clorat
Là một chất oxy hóa mạnh, có thể tác dụng với nhiều phi kim và kim loại như cacbon, photpho, nhôm, lưu huỳnh, magie,…
2KClO3 + 3S → 2KCl + 3SO2
KClO3 + 3Mg → KCl + 3MgO
5KClO3 + 6P → 5KCl + 3P2O5
Các phương trình phản ứng khác:
KClO3 + 6HCl → 3Cl2 + KCl + 3H2O
2KClO3 + 3MnO2 → 2KMnO4 + MnCl2 + 2O2
KClO3 + 3H2 → KCl + 3H2O
5. Điều chế kali clorat
Kali Clorat được điều chế bằng cách: cho KOH phản ứng với khí clo ở điều kiện nhiệt độ trên 80oC
6KOH + 3Cl2 → KClO3 + 5KCl + 3H2O
Ngoài ta, còn có thể sản xuất Kali Clorat bằng cách điện phân dung dịch KCl 25% ở nhệt độ từ 70 – 75 oC
2KCl + 2H2O → 2KOH + H2 + Cl2
Xem thêm : Bảng màu sơn xịt WIN – Mã màu sơn phun chịu nhiệt, chống rỉ sét
6KOH + 3Cl2 → 5KCl + KClO3 + H2O
>>> Kali Clorua KCl
Phương trình nhiệt phân KClO3
Phản ứng nhiệt phân là phản ứng phân hủy của các hợp chất hóa học xảy ra khi có sự xúc tác của nhiệt độ. Khi nhiệt phân KClO3 sẽ tạo ra khí O2 cùng muối kali clorua và tùy thuộc vào điệu kiện nhiệt độ sẽ thu được phương trình hay các sản phẩm khác nhau.
- Ở nhiệt độ 400 oC: tạo ra muối kali peclorat cùng kali clorua
4KClO3 → 3KClO4 + KCl
- Đối với nhiệt độ 500 oC: tạo ra khí oxi và muối kali clorua
2KClO3 → 2KCl + 3O2
- Ở nhiệt độ dưới 500 độ C, sản phẩm nhiệt phân tạo ra là kali clorua và oxy nhưng có sự tham gia của chất xúc tác MnO2.
Như vậy, khi nhiệt phân KClO3 sẽ tạo nên hai muối kali là muối clorat KClO4 (có tính oxy hóa) và muối clorua KCl (không có tính oxy hóa), nếu có sự tham gia của chất xúc tác MnO2 sẽ tạo ra muối KCl và O2.
>>> Kali Nitrat KNO3 là gì? Muối kali nitrat có ở đâu trong tự nhiên?
Ngoài ra, đối với muối hipoclorit ClO- và muối clorit ClO2- cũng có phương trình nhiệt phân sau
2KClO → KClO2 + KCl
3KClO2 → 2KClO3 + KCl
4KClO3 → 3KClO4 + KCl
KClO4 → KCl + 2O2
Bài tập áp dụng
Bài 1: Nhiệt phân 73,5g muối KClO3. Tính khối lượng và thể tích khí Oxi thu được sau phản ứng.
Lời giải:
– Ta có phương trình phản ứng: 2KClO3 → 2KCl + 3O2
– nKClO3 = 73,5/122,5 = 0,6(mol)
Xem thêm : Sáng tạo là gì? Tại sao lại cần sáng tạo trong công việc?
– Ta có: nO2=3.nKClO3/2 = 3.0,6/2 = 0,9(mol)
> Khối lượng khí O2 thu được là: mO2 = nO2.MO2 = 0,9.32 = 28,8(gam)
> Thể tích khí O2 thu được ở điều kiện tiêu chuẩn là: VO2(đktc) = nO2.22,4 = 0,9.22,4 = 20,16(lít)
Bài 2: Nhiệt phân KClO3 (xúc tác MnO2). Cần nhiệt phân bao nhiêu gam KClO3 để có thể thu được 6,72 lít O2 (điều kiện tiêu chuẩn)
Lời giải:
– Phương trình nhiệt phân 2KClO3 → 2KCl + 3O2
+ nKClO3 = 0,2(mol)
+ Khối lượng KClO3 là: 0,2×212,5=42,5(gam)
Ứng dụng của kali clorat KClO3
- Được ứng dụng trong chế tạo thuốc nổ, pháo hoa, ngòi nô hay trong các hỗn hợp dễ cháy khác.
- Trong sản xuất diêm (chiếm 50 % ở đầu mỗi que diêm)

KClO3 ứng dụng trong sản xuất diêm
- Là một chất khử màu trong dệt nhuộm vải và chất chống oxy hóa
- Trong phòng thí nghiệm: dùng để điều chế oxi bằng phương pháp nhiệt phân có sự xúc tác của MnO2
- Trong nông nghiệp: sử dụng làm chất điều hòa cây trồng

Kali clorat sử dụng trong điều hòa cây trồng
>>> AgNO3 Bạc Nitrat là gì? Ứng dụng của hóa chất AgNO3
Mua KClO3 Kali Clorat ở đâu uy tín, chất lượng?
Để đảm bảo an toàn khi sử dụng cũng như đạt kết quả mong muốn, khách hàng nên lựa chọn địa chỉ bán hóa chất uy tín. Tự hào với hơn 20 năm kinh nghiệm trong lĩnh vực cung ứng hóa chất, vietChem sẽ là đơn vị uy tín mà bạn không nên bỏ qua. Không chỉ các sản phẩm về Kali Clorat mà tất cả các hóa chất khác tại VietChem mang đến luôn được đảm bảo về mặt chất lượng cũng giá thành. Nếu có thắc mắc gì về sản phẩm hay muốn đặt mua hàng, quý khách vui lòng liên hệ với VietChem qua số hotline hoặc website. Đội ngũ chuyên viên chuyên sâu luôn sẵn sang hỗ trợ mọi vướng mắc của quý khách.
Qua bài viết trên của VietChem, mong rằng đã giúp bạn đọc có cái nhìn tổng quan hơn về Kali Clorat KClO3 là gì, tính chất đặc biệt là phản ứng nhiệt phân, cách điều chế cũng như ứng dụng ra sao. Thường xuyên đón đọc trên hoachat.com.vn để có thêm kiến thức về các loại hóa chất cũng như những điều thú vị xoay quanh cuộc sống của chúng ta.
Tìm kiếm liên quan:
– Kclo4
– KClO3 ra KClO4
Nguồn: https://thcshongthaiad.edu.vn
Danh mục: Tra Cứu


